
| A.①③ | B.③④ | C.②③ | D.②④ |


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源:不详 题型:单选题
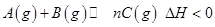 ,在不同条件下反应混合物中C的百分含量反应过程所需时间的关系曲线。下列有关叙述正确的是
,在不同条件下反应混合物中C的百分含量反应过程所需时间的关系曲线。下列有关叙述正确的是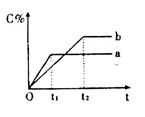
| A.反应由逆反应开始 |
| B.a表示有催化剂,b表示无催化剂 |
| C.若n=2,其它条件相同,a比b的压强大 |
| D.若其它条件相同,a比b的温度高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2(g) +CO2(g) ΔH<0,改变其中一种条件,能加快反应速率且反应放出的热量不变的是
H2(g) +CO2(g) ΔH<0,改变其中一种条件,能加快反应速率且反应放出的热量不变的是| A.升高温度 | B.减小压强 | C.加入CO | D.加入催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 试 管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30 s | 2 s |
| 试 管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100 s | 90 s |
| 试 管 | 滴入10滴稀硫酸的试管 | 加入1 mL稀硫酸的试管 | 加入2 mL稀硫酸的试管 |
| 褪色时间 | 70 s | 100 s | 120 s |
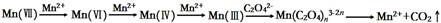
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
| 浓度(mol·L-1) | 体积(mL) | 浓度(mol·L-1) | 体积 (mL) | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.护发素的主要功能是调节头发的pH,使之达到适宜的酸碱度 |
| B.厕所清洁剂、醋、肥皂、厨房清洁剂的pH依次增大 |
| C.仅用1mol/L KI溶液、0.1mol/L H2SO4溶液和淀粉溶液(仪器不限),就可以探究温度对化学反应速率的影响 |
| D.将少量Mg(OH)2沉淀和适量氯化铵溶液混合,无明显现象 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
| B.增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快 |
| C.对于有气体参加的反应通过压缩容器增大压强,可使单位体积内活化分子增多,反应速率加快 |
| D.活化分子之间的碰撞一定是有效碰撞 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com