
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
分析 (1)由表中数据可知,50s内△n(PCl3)=0.16mol,由方程式可知△n(PCl5)=△n(PCl3),根据v=$\frac{\frac{△n}{V}}{△t}$计算v(PCl5);
正反应为气体物质的量增大的反应,则混乱度增大;
(2)温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,平衡时n(PCl3)=0.2mol,则:
PCl5(g)?PCl3(g)+Cl2(g)
开始(mol/L):0.5 0 0
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
再根据K=$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{5})}$计算平衡常数;
(3)PCl3的体积分数=$\frac{PC{l}_{3}物质的量}{混合气体总物质的量}$×100%;
要提高平衡时PCl3的体积分数,改变条件平衡正向移动,但不能减小PCl3的浓度,注意改变PCl5的浓度等效为压强改变;
(4)平衡时PCl5的转化率仍为20%,转化的PCl5为0.5mol×20%=0.1mol,表示出平衡时各组分物质的量,再根据平衡常数列方程计算解答;
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),还生成HCl.
解答 解:(1)由表中数据可知,50s内△n(PCl3)=0.16mol,由方程式可知△n(PCl5)=△n(PCl3)=0.16mol,则v(PCl5)=$\frac{\frac{0.16mol}{2L}}{50s}$=0.0016mol/(L•s),
正反应为气体物质的量增大的反应,则混乱度增大,故△S>0,
故答案为:0.0016mol/(L•s);>;
(2)温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,平衡时n(PCl3)=0.2mol,则:
PCl5(g)?PCl3(g)+Cl2(g)
开始(mol/L):0.5 0 0
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
则平衡常数K=$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{5})}$=$\frac{0.1×0.1}{0.4}$=0.025,
故答案为:0.025;
(3)由(2)中计算数据可知,平衡时PCl3的体积分数=$\frac{0.1mol/L}{0.6mol/L}$×100%=16.7%;
A.温度不变,压缩容器体积增大压强,平衡逆向移动,PCl3的体积分数减小,故A错误;
B.使用高效催化剂,不影响平衡移动,PCl3的体积分数不变,故B错误;
C.温度和体积不变,减小PCl5的起始量,等效为降低压强,平衡正向移动,PCl3的体积分数增大,故C正确;
D.体积不变,提高反应温度,正反应为吸热反应,平衡正向移动,PCl3的体积分数增大,故D正确,
故答案为:16.7%;CD;
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2,平衡时PCl5的转化率仍为20%,则转化的PCl5为0.5mol×20%=0.1mol,反应正向进行,则:
PCl5(g)?PCl3(g)+Cl2(g)
开始(mol/L):0.25 0 0.5a
变化(mol/L):0.05 0.05 0.05
平衡(mol/L):0.2 0.05 0.5a+0.05
则平衡常数K=$\frac{(0.5a+0.05)×0.05}{0.2}$=0.025,解得a=0.1
故答案为:0.1;
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),还生成HCl,反应方程式为:PCl5+4H2O=H3PO4+5HCl,
故答案为:PCl5+4H2O=H3PO4+5HCl.
点评 本题考查化学平衡计算与影响因素、反应速率、平衡常数计算等,难度中等,(4)中注意利用平衡常数进行计算解答.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管内气体呈红棕色 | B. | 试管内气体无色,是NO | ||
| C. | 试管内气体无色,是O2 | D. | 试管内液面下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | 0.5H2SO4(aq)+0.5Ba(OH)2(aq)═0.5BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
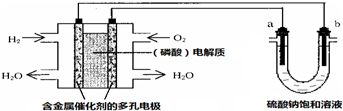
| A. | 电池工作时,正极反应式为:O2+4H++4e-═2H2O | |
| B. | 电解时,当阴极逸出amol气体,同时有W克Na2SO4﹒10H2O 析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是$\frac{71W}{161(W+36a)}$×100% | |
| C. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 忽略能量损耗,当电池中消耗0.01g O2时,b 极周围会产生0.02g H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重.因此由PM2.5引起的雾霾一定属于气溶胶 | |
| B. | 纪录片中详细阐述了煤的大量燃烧是产生雾霾的主要原因,如果使用前对煤进行脱硫处理,可减少二氧化硫的排放;石膏法脱硫工艺是一种常用的脱硫技术 | |
| C. | 汽车尾气中的氮氧化物和碳氢化合物在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物--光化学烟雾也会引起雾霾,汽车尾气中含有氮氧化物,原因是汽油燃烧不充分 | |
| D. | 多植树造林,使用“乙醇汽油”,改燃煤为燃气,外出时使用PM2.5的口罩等都是治理“雾霾”等灾害性天气的有效措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物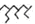 的名称为2,4 一二乙基-6-丙基辛烷 的名称为2,4 一二乙基-6-丙基辛烷 | |
| B. | 月桂烯 (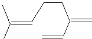 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 向浓醋酸溶液中加入少量碳酸钠溶液,将产生气体通入苯酚钠溶液,苯酚钠溶液中出现白色浑浊,说明酸性:醋酸>碳酸>苯酚 | |
| D. | 在盛有试粉溶液的试管中加入70%的硫酸边搅拌边加热5分钟,冷却至室温,再加入氢氧化钠中和至碱性.加入银氨溶液水浴加热,产生银镜.说明淀粉水解能产生还原性糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
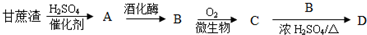
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com