
°ĺŐ‚ńŅ°ŅņŻ”√ļ£ňģŅ…“‘ŐŠ»°šŚļÕ√ĺ£¨ŐŠ»°Ļż≥Ő»ÁŌ¬£ļ
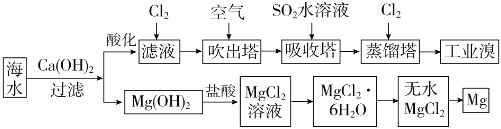
£®1£©ŐŠ»°šŚĶńĻż≥Ő÷–£¨ĺ≠Ļż2īő![]() ◊™ĽĮĶńńŅĶń «__________£¨őŁ ’ňĢ÷–∑Ę…ķ∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺ «
◊™ĽĮĶńńŅĶń «__________£¨őŁ ’ňĢ÷–∑Ę…ķ∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺ «![]() £¨’ŰŃůňĢ÷–∑Ę…ķ∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺ «____________°£
£¨’ŰŃůňĢ÷–∑Ę…ķ∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺ «____________°£
£®2£©ī”![]() »‹“ļ÷–Ķ√ĶĹ
»‹“ļ÷–Ķ√ĶĹ![]() ĺßŐŚĶń÷ų“™≤Ŕ◊ų «__________°Ę_________°ĘĻż¬ň°ĘŌīĶ”°Ęł…‘Ô°£”…őřňģ¬»ĽĮ√ĺĶ√ĶĹ√ĺĶńĽĮ—ß∑Ĺ≥Ő Ĺ «__________°£
ĺßŐŚĶń÷ų“™≤Ŕ◊ų «__________°Ę_________°ĘĻż¬ň°ĘŌīĶ”°Ęł…‘Ô°£”…őřňģ¬»ĽĮ√ĺĶ√ĶĹ√ĺĶńĽĮ—ß∑Ĺ≥Ő Ĺ «__________°£
£®3£©ĺ›…Ō ŲŃų≥Ő£¨Ĺę![]() ļ£ňģ÷–šŚ‘™ňō£®ļ£ňģ÷–
ļ£ňģ÷–šŚ‘™ňō£®ļ£ňģ÷–![]() ņŽ◊”ļ¨ŃŅő™
ņŽ◊”ļ¨ŃŅő™![]() £©◊™ĽĮő™Ļ§“ĶšŚ£¨’ŻłŲŃų≥Ő÷–÷Ń…Ŕ–Ť“™ĪÍ◊ľ◊īŅŲŌ¬
£©◊™ĽĮő™Ļ§“ĶšŚ£¨’ŻłŲŃų≥Ő÷–÷Ń…Ŕ–Ť“™ĪÍ◊ľ◊īŅŲŌ¬![]() ĶńŐŚĽżő™_________L£®ļŲ¬‘
ĶńŐŚĽżő™_________L£®ļŲ¬‘![]() »‹Ĺ‚£©°£
»‹Ĺ‚£©°£
°ĺīūįł°Ņ ∂‘šŚ‘™ňōĹÝ––łĽľĮ ![]() ľ”»»Ň®ňű ņš»īĹŠĺß
ľ”»»Ň®ňű ņš»īĹŠĺß ![]() 179.2
179.2
°ĺĹ‚őŲ°Ņļ£ňģ÷–ľ”»Ž«‚—űĽĮł∆≥ŃĶŪ√ĺņŽ◊”ļůĻż¬ň£¨‘ŕ¬ň“ļ÷–Õ®»Ž¬»∆Ý «Ĺę¬ň“ļ÷–ĶńBr-—űĽĮő™Br2£¨‘ŔņŻ”√»»ĶńŅ’∆ÝĹęBr2īĶ≥Ų£¨ĹÝ»ŽőŁ ’ňĢ”ŽSO2∑ī”¶£¨∆š∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺő™£ļSO2+Br2+2H2O=2HBr+H2SO£Ľ‘ŔÕ®»Ž¬»∆ÝĹęBr-—űĽĮő™Br2£¨ŃĹīőBr-°ķBr2◊™ĽĮĶńńŅĶń «∂‘šŚ‘™ňōĹÝ––łĽľĮ£¨«‚—űĽĮ√ĺľ”»Ž—őňŠ»‹Ĺ‚Ķ√ĶŬ»ĽĮ√廋“ļ£¨¬»ĽĮ√廋“ļ÷–Ķ√ĶŬ»ĽĮ√ĺĺßŐŚĶń≤Ŕ◊ų «ľ”»»’Ű∑Ęņš»īĹŠĺßĶ√ĶĹőřňģ¬»ĽĮ√ĺ£¨ĶÁĹ‚»Ř»ŕ¬»ĽĮ√ĺĶ√ĶĹĹū Ű√ĺ£Ľ
£®1£©łý囓‘…Ō∑÷őŲŅ…÷™Ńų≥Ő÷–ŐŠ»°šŚĶńĻż≥Ő÷–£¨ĺ≠Ļż2īőBr-°ķBr2◊™ĽĮĶńńŅĶń «ő™ŃňĶ√ĶĹłŁ∂ŗĶńšŚĶ•÷ £¨ŐŠ»°Ļż≥Ő∂‘šŚ‘™ňōĹÝ––łĽľĮ£ĽőŁ ’ňĢńŕÕ®»ŽĶń∂Ģ—űĽĮŃÚ∆ÝŐŚ «ļÕšŚĶ•÷ ∑ī”¶…ķ≥…šŚņŽ◊”£¨‘ŕ’ŰŃůňĢ÷–ĪĽ¬»∆Ý—űĽĮĶ√ĶĹłŁ∂ŗĶńšŚĶ•÷ £¨∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺ «Cl2+2Br£≠£ĹBr2+2Cl£≠£Ľ£®2£©ī”MgCl2»‹“ļ÷–Ķ√ĶĹMgCl26H2OĺßŐŚĶń÷ų“™≤Ŕ◊ų «’Ű∑ĘŇ®ňű°Ęņš»īĹŠĺß°ĘĻż¬ň°ĘŌīĶ”Ķ√ĶĹ£ĽĶÁĹ‚»Ř»ŕ¬»ĽĮ√ĺĶ√ĶĹĹū Ű√ĺļÕ¬»∆Ý£¨∑ī”¶ĶńĽĮ—ß∑Ĺ≥Ő Ĺő™£ļMgCl2£®»Ř»ŕ£©![]() Mg+Cl2°Ł£Ľ£®4£©»ŰĹę10m3ļ£ňģ÷–ĶńšŚ‘™ňō◊™ĽĮő™Ļ§“ĶšŚ£¨“ņ囚Ś‘™ňōļ¨ŃŅő™64mg/L£¨10m3ļ£ňģ÷–ļ¨šŚ‘™ňō=10°Ń1000L°Ń64g/L°Ń10-3=640g£ĽőÔ÷ ĶńŃŅ=640g°¬80g/mol=8mol£¨“ņĺ›∑ī”¶ľ∆ň„Ķ√ĶĹ£ļCl2+2Br£≠£ĹBr2+2Cl£≠£¨ŌŻļń¬»∆ÝőÔ÷ ĶńŃŅő™£ļ4mol£ĽŐŠ»°Ļż≥Ő÷––Ť“™ŃĹīőÕ®»Ž¬»∆Ý ĶŌ÷šŚņŽ◊”ĪĽ—űĽĮ£¨ňý“‘÷Ń…Ŕ–Ť“™ĪÍ◊ľ◊īŅŲŌ¬Cl2ĶńőÔ÷ ĶńŃŅő™8 mol£¨ĪÍ◊ľ◊īŅŲŌ¬ŐŚĽżő™8mol°Ń22.4L/mol=179.2L°£
Mg+Cl2°Ł£Ľ£®4£©»ŰĹę10m3ļ£ňģ÷–ĶńšŚ‘™ňō◊™ĽĮő™Ļ§“ĶšŚ£¨“ņ囚Ś‘™ňōļ¨ŃŅő™64mg/L£¨10m3ļ£ňģ÷–ļ¨šŚ‘™ňō=10°Ń1000L°Ń64g/L°Ń10-3=640g£ĽőÔ÷ ĶńŃŅ=640g°¬80g/mol=8mol£¨“ņĺ›∑ī”¶ľ∆ň„Ķ√ĶĹ£ļCl2+2Br£≠£ĹBr2+2Cl£≠£¨ŌŻļń¬»∆ÝőÔ÷ ĶńŃŅő™£ļ4mol£ĽŐŠ»°Ļż≥Ő÷––Ť“™ŃĹīőÕ®»Ž¬»∆Ý ĶŌ÷šŚņŽ◊”ĪĽ—űĽĮ£¨ňý“‘÷Ń…Ŕ–Ť“™ĪÍ◊ľ◊īŅŲŌ¬Cl2ĶńőÔ÷ ĶńŃŅő™8 mol£¨ĪÍ◊ľ◊īŅŲŌ¬ŐŚĽżő™8mol°Ń22.4L/mol=179.2L°£



| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–őÔ÷ Ķń∑÷ņŗ’ż»∑Ķń «
ľÓ | ňŠ | —ő | ľÓ–‘—űĽĮőÔ | ňŠ–‘—űĽĮőÔ | |
A | Na2CO3 | HCl | NaOH | SO2 | CO2 |
B | NaOH | H2SO4 | NaCl | Na2O | CO2 |
C | KOH | HNO3 | CaCO3 | CaO | CO |
D | NaOH | HCl | CaF2 | Na2O2 | SO2 |
A.AB.BC.CD.D
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅĻ§“Ķ÷∆ŃÚňŠĻż≥Ő÷–£¨SO2ĶńīŖĽĮ—űĽĮ «÷ų“™∑ī”¶÷ģ“Ľ£ģő™Ńň—–ĺŅÕ‚ĹÁŐűľĢ∂‘ł√∑ī”¶Ķń”įŌž£¨Ĺę0.050mol SO2£®g£©ļÕ0.030mol O2£®g£©∑Ň»Ž»›Ľżő™1LĶń√‹Ī’»›∆ų÷–£¨∑ī”¶£ļ
2SO2£®g£©+O2£®g£©2SO3£®g£©°ųH£ľ0£¨‘ŕ“Ľ∂®ŐűľĢŌ¬īÔĶĹ∆Ĺļ‚£¨≤‚Ķ√c£®SO3£©=0.040mol/L£ģ
£®1£©Ň–∂Ōł√∑ī”¶īÔĶĹ∆Ĺļ‚◊īŐ¨ĶńĪÍ÷ĺ «£®ŐÓ◊÷ńł£©
A.SO2ļÕSO3Ň®∂»ŌŗĶ»
B.SO2įŔ∑÷ļ¨ŃŅĪ£≥÷≤ĽĪš
C.»›∆ų÷–∆ÝŐŚĶń—Ļ«Ņ≤ĽĪš
D.SO3Ķń…ķ≥…ňŔ¬ ”ŽSO2ĶńŌŻļńňŔ¬ ŌŗĶ»
E.»›∆ų÷–ĽžļŌ∆ÝŐŚĶń√‹∂»Ī£≥÷≤ĽĪš
£®2£©ĶĪł√∑ī”¶ī¶”ŕ∆Ĺļ‚◊īŐ¨ Ī£¨‘ŕŐŚĽż≤ĽĪšĶńŐűľĢŌ¬£¨Ō¬Ń–īŽ ©÷–”–ņŻ”ŕŐŠłŖSO2∆Ĺļ‚◊™ĽĮ¬ Ķń”– £ģ £®ŐÓ◊÷ńł£©
A.…żłŖő¬∂»
B.ĹĶĶÕő¬∂»
C.‘Ųīů—Ļ«Ņ
D.ľű–°—Ļ«Ņ
E.ľ”»ŽīŖĽĮľŃ G£ģ“∆≥Ų—ű∆Ý
£®3£©ľ∆ň„ł√ŐűľĢŌ¬∑ī”¶Ķń∆Ĺļ‚≥£ żK= £ģ SO2Ķń∆Ĺļ‚◊™ĽĮ¬ ő™ £ģ
£®4£©SO2ő≤∆Ý”√Ī•ļÕNa2SO3»‹“ļőŁ ’Ņ…Ķ√ĶĹłŁ“™ĶńĽĮĻ§‘≠ŃŌ£¨∑ī”¶ĶńĽĮ—ß∑Ĺ≥Ő Ĺő™ £ģ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–ňĶ∑®÷–’ż»∑Ķń «(°°°°)
A. ‘ŕ∆ÝŐŚĶ•÷ ∑÷◊”÷–£¨“Ľ∂®ļ¨”–¶“ľŁ£¨Ņ…ń‹ļ¨”–¶–ľŁ
B. Ō©ŐĢĪ»ÕťŐĢĶńĽĮ—ß–‘÷ ĽÓ∆√ «”…”ŕÕťŐĢ÷–÷Ľļ¨¶“ľŁ∂ÝŌ©ŐĢļ¨”–¶–ľŁ
C. Ķ»ĶÁ◊”ŐŚĹŠĻĻŌŗň∆£¨ĽĮ—ß–‘÷ ŌŗÕ¨
D. Ļ≤ľŘľŁĶń∑ĹŌÚ–‘ĺŲ∂®Ńň‘≠◊”‘ŕ–ő≥…∑÷◊” ĪŌŗĽ•ĹŠļŌĶń żŃŅĻōŌĶ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ“—÷™Ō¬Ń–∑ī”¶£ļ
2CO£®g£©+O2£®g£©=2CO2£®g£©°ųH=©Ā566kJ/mol
Na2O2£®s£©+CO2£®g£©=Na2CO3£®s£©+ ![]() O2£®g£©°ųH=©Ā266kJ/mol
O2£®g£©°ųH=©Ā266kJ/mol
‘Ľōīū£ļ
£®1£©‘ŕīŖĽĮľŃ◊ų”√Ō¬£¨“Ľ—űĽĮŐľŅ…”ŽĻż—űĽĮń∆∑ī”¶…ķ≥…ĻŐŐŚŐľňŠń∆£¨ł√∑ī”¶Ķń»»ĽĮ—ß∑Ĺ≥Ő Ĺő™£ļ £ģ
£®2£©’”∆Ý «“Ľ÷÷ń‹‘ī£¨ňŁ÷ų“™≥…∑÷ «CH4 £ģ 0.5mol CH4Õͻ껾…’…ķ≥…CO2ļÕ“ļŐ¨ňģ Ī£¨∑Ň≥Ų445kJ»»ŃŅ£¨‘Ú∆š»ľ…’Ķń»»ĽĮ—ß∑Ĺ≥Ő Ĺő™£ļ £ģ
£®3£©SiH4 «“Ľ÷÷őř…ęĶń∆ÝŐŚ£¨”ŲĶĹŅ’∆Ýń‹∑Ę…ķĪ¨’®–‘◊‘»ľ£¨…ķ≥…SiO2£®s£©ļÕH2O£®l£©£¨“—÷™ “ő¬Ō¬3.2gSiH4◊‘»ľ∑Ň≥Ų»»ŃŅ79.2kJ£¨∆š»»ĽĮ—ß∑Ĺ≥Ő Ĺő™£ļ £ģ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–”–ĻōőÔ÷ Ķń∑÷ņŗ»ę≤Ņ’ż»∑Ķń «
—°ŌÓ | őÔ÷ | ∑÷ņŗ |
A | őŪŲ≤°Ęňģ“Ý°ĘĪýňģĽžļŌőÔ | ĽžļŌőÔ |
B | Ba(OH)2°Ę…’ľÓ°Ę…ķ ĮĽ“ | ľÓ |
C | ¬»ĽĮń∆°ĘCaCO3°ĘőřňģŃÚňŠÕ≠ | —ő |
D | CO°ĘCO2°ĘMn2O7 | ňŠ–‘—űĽĮőÔ |
A.AB.BC.CD.D
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ∂‘”ŕ∑ī”¶2NO2(g) ![]() N2O4(g)£¨‘ŕ“Ľ∂®ŐűľĢŌ¬īÔĶĹ∆Ĺļ‚£¨‘ŕő¬∂»≤ĽĪš Ī£¨”Ż Ļ
N2O4(g)£¨‘ŕ“Ľ∂®ŐűľĢŌ¬īÔĶĹ∆Ĺļ‚£¨‘ŕő¬∂»≤ĽĪš Ī£¨”Ż Ļ![]() ĶńĪ»÷Ķ‘Ųīů£¨”¶≤…»°ĶńīŽ © «
ĶńĪ»÷Ķ‘Ųīů£¨”¶≤…»°ĶńīŽ © «
ĘŔŐŚĽż≤ĽĪš£¨‘Ųľ”NO2ĶńőÔ÷ ĶńŃŅ°° ĘŕŐŚĽż≤ĽĪš£¨‘Ųľ”N2O4ĶńőÔ÷ ĶńŃŅ°°
ĘŘ ĻŐŚĽż‘ŲīůĶĹ‘≠ņīĶń2Ī∂ Ę‹≥š»ŽN2£¨Ī£≥÷—Ļ«Ņ≤ĽĪš
A. ĘŔĘŕ B. ĘŕĘŘ C. ĘŔĘ‹ D. ĘŘĘ‹
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–√Ť Ų÷–≤Ľ’ż»∑Ķń « (°°°°)
A. CS2ő™÷ĪŌŖ–őĶń∑«ľę–‘∑÷◊”
B. ClO3£≠ĶńŃĘŐŚĻĻ–Õő™∆Ĺ√ś»żĹ«–ő
C. SF6÷–”–6∂‘ÕÍ»ęŌŗÕ¨Ķń≥…ľŁĶÁ◊”∂‘
D. SiF4ļÕSO32£≠Ķń÷––ń‘≠◊”ĺýő™sp3‘”ĽĮ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņłý图Łń‹ żĺ›(H°™Cl 431 kJ/mol£¨H°™I 297 kJ/mol)£¨Ņ…Ķ√≥ŲĶńĹŠ¬Ř « (°°°°)
A. »‹”ŕňģ Ī£¨HIĪ»HClłŁ»›“◊ĶÁņŽ£¨ňý“‘«‚Ķ‚ňŠ ««ŅňŠ
B. HIĪ»HCl»Ř°Ę∑–Ķ„łŖ
C. HIĪ»HClő»∂®
D. ≤ūŅ™Ķ»őÔ÷ ĶńŃŅĶńHIļÕHCl£¨HIŌŻļńĶńń‹ŃŅ∂ŗ
≤ťŅīīūįłļÕĹ‚őŲ>>
įŔ∂»÷¬–Ň - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com