
下列图示与对应的叙述正确的是

A.图甲为在水溶液中H+和OH-的浓度变化曲线,恒温稀释可实现a→b的转化
B.图乙为H2O2在有、无催化剂下的分解反应曲线b表示有催化剂时的反应
C.图丙可表示用0.0110mol/L盐酸滴定0.0110mol/L氨水时的滴定曲线
D.图丁为NaCl中混有少量KNO3,除去KNO3可在较高温度下制得浓溶液再冷却结晶、过滤、干燥
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源:2016-2017学年新疆兵团第二师华山中学高二上学期期末考试化学试卷(解析版) 题型:选择题
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)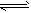 Z(g)+W(s)ΔH>0下列叙述正确的是( )
Z(g)+W(s)ΔH>0下列叙述正确的是( )
A. 加入少量W,逆反应速率增大
B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动
D. 平衡后加入X,上述反应的ΔH增大
查看答案和解析>>
科目:高中化学 来源:江西省新余市、宜春中学2017届高三下学期开学联考理科综合-化学试卷 题型:简答题
软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
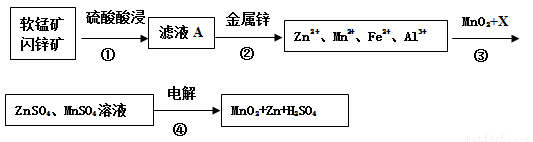
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是_________________(任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_________。
(3)步骤③中MnO2的其作用是__________________,另外一种物质X可以是__________。
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式__________。
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为__________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______。[已知:Ksp(MnS)=1.4×10―15]
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三12月月考化学卷(解析版) 题型:选择题
下列说法中,不正确的是(设NA表示阿伏伽德罗常数)
A.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝
B.向氢氧化镁悬浊液中加入浓的NH4Cl溶液,因发生化学反应而溶解
C.足量的Cu与含2molH2SO4的浓硫酸充分反应可生成NA个SO2分子
D.氢氧化铝溶于强碱溶液,说明铝具有一定的非金属性
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次模拟化学卷(解析版) 题型:实验题
铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:
(1)“酸溶”时加快反应速率的方法有________________________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2+ +2SO42-+16H+,则另一个反应的离子方程式为:___________________;②FeS2还原后,检验Fe3+是否反应完全的方法是_______________________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有____________杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_______________________。
(4)FeCO3浊液长时间暴露在空气中,会有部 分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________________(填化学式)。
分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO.现煅烧23.2kg的FeCO3,得到Fe2O3和FeO的混合物15.84kg.则Fe2O3的质量为___________kg。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次模拟化学卷(解析版) 题型:选择题
某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是
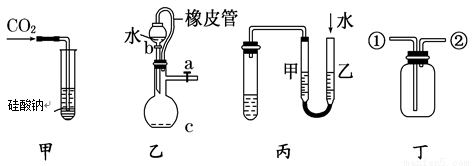
A. 甲装置:可用来证明碳的非金属性比硅强
B. 乙装置:橡皮管的作用是能使水顺利流下
C. 丙装置:用图示的方法不能检查此装置的气密性
D. 丁装置:先从①口进气集满CO2,再从②口进气,可收集NO
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次模拟化学卷(解析版) 题型:选择题
有a、b、c、d四种元素,均为原子序数依次增大的前20号元素。a存在a+和a-两种离子,b和c为同一主族元素,c的次外层有8个电子,c2-和d2+的电子层结构相同。下列叙述正确的是
A. b、c与a形成化合物的稳定性一定为c>b
B. a和d形成的化合物与水反应产生气体可以作燃料
C. c、a和b可形成的化合物为离子化合物
D. a 、b、c、d四种元素组成的化合物的水溶液可以为酸性、也可以为碱性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
25℃时,5种银盐的溶度积常数(Ksp)分别是:
AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法正确的是
A. 氯化银、溴化银和碘化银的溶解度依次增大
B. 将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀
C. 在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3 mol/L的AgNO3溶液,能观察到白色沉淀
D. 将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成窗体顶端
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(解析版) 题型:选择题
下列物质的分离提纯方法选择不正确的是
A | 除去氯化钠溶液中的泥沙 | 过滤 |
B | 用四氯化碳提取溴水中的溴 | 萃取 |
C | 分离乙酸(沸点 118℃ )与乙酸乙酯(沸点 77℃ ) | 分液 |
D | 从含有少量氯化钠的硝酸钾溶液中提取硝酸钾 | 结晶 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com