
碱式碳酸铝镁
[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和________________________________。
(2)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为________。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390 g 样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率( ×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO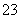 )(写出计算过程)。
)(写出计算过程)。
(1)生成的产物具有阻燃作用 (2)2a+3b=c+2d
(3)n(CO2)=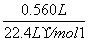 =2.50×10-2mol
=2.50×10-2mol
m(CO2)=2.50×10-2 mol×44 g·mol-1=1.10 g
在270~600 ℃之间,失去结晶水后的样品进一步受热分解放出CO2和H2O
m(CO2)+m(H2O)=3.390 g×(0.734 5-0.370 2)=1.235 g
m(H2O)=1.235 g-1.10 g=0.135 g
n(H2O)=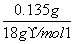 =7.50×10-3 mol
=7.50×10-3 mol
n(OH-)=7.50×10-3 mol×2=1.50×10-2 mol
n(OH-)∶n(CO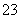 )=1.50×10-2 mol∶2.50×10-2 mol=3∶5
)=1.50×10-2 mol∶2.50×10-2 mol=3∶5
[解析] (1)碱式碳酸铝镁分解后生成Al2O3、MgO、CO2,这些物质都可起到阻燃作用。(2)根据化合物中各元素的化合价代数和为0,故2a+3b+(-1)c+(-2)d=0,即2a+3b=c+2d。(3)利用标准状况下CO2的体积计算所含CO2的物质的量,从而求出CO2的质量;再结合图像,求出分解过程中生成H2O的质量,从而求出H2O的物质的量。解题时要特别注意:①固体残留率在73.45%以前,结晶水已经全部失去,此时减少的质量为分解生成的CO2和H2O,②固体分解可看成是镁铝的氢氧化物及其碳酸盐的分解,故分解生成1 mol H2O需要2 mol OH-,分解生成1 mol CO2需要1 mol CO 。
。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积与生成沉淀的质量关系如右图,
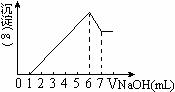
则合金中镁和铝的质量比是()
A、1∶1
B、8∶9
C、4∶3
D、4∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是( )
A.Cu溶于稀HNO3:
Cu+2H++NO ===Cu2++NO2↑+H2O
===Cu2++NO2↑+H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制
Fe(OH)2:Fe2++2OH-===Fe(OH)2↓
C.用CH3COOH溶解CaCO3:
CaCO3+2H+===Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:
CO2+AlO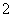 +2H2O===Al(OH)3↓+HCO
+2H2O===Al(OH)3↓+HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一种中强酸,写出其电离方程式:_____________________________
________________________________________________________________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
③NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显________(填“弱酸性”“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________________________________________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式:_________________________________________。
②分析产品室可得到H3PO2的原因:_____________________________________
________________________________________________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S (n-1)S+S2-===S

①写出电解时阴极的电极反应式:________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________。
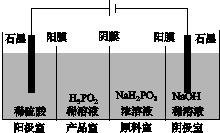
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
①在图示的转化中,化合价不变的元素是________。
②反应中当有1 mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有________________。
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为__________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式的书写及评价均合理的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将2 mol Cl2通入到含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
| B | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++HCO | 正确;酸式盐与碱反应生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-===HClO+HSO | 正确; 说明酸性: H2SO3强于HClO |
| D | 1 mol/L NaAlO2溶液和2.5 mol/L HCl溶液等体积均匀混合:2AlO | 正确;AlO |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于乙醇的说法不正确的是( )
A.乙醇是具有特殊气味的液体
B.乙醇分子里含有6个氢原子,它们的性质是完全一样的
C.乙醇易挥发,与水任意比互溶
D.乙酸的熔沸点比乙醇高
查看答案和解析>>
科目:高中化学 来源: 题型:
M、N为短周期的两种元素,M元素原子的最外层电子数≤4,N元素原子的最外层电子数>4,下列对其中说法正确的是
A.M、N可能为金属
B.若M、N为同周期元素,则原子半径M<N
C.M、N元素的单质可能与水发生置换反应
D.M、N形成的离子化合物不能体现强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH 、Cl-、S2-
、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO 、I-
、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO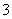
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO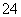
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com