
| A. |  干电池 | B. |  电解水 | C. |  太阳能热水器 | D. |  水力发电 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是从源头上消除工业生产对环境的污染 | |
| B. | “硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
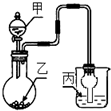 用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )
用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )| 选项 | 液体甲 | 固体乙 | 溶液丙 | 丙中现象 |
| A | CH3COOH | NaHCO3 | 苯酚钠 | 无明显现象 |
| B | 浓HCl | KMnO4 | 紫色石蕊 | 最终呈红色 |
| C | 浓H2SO4 | Na2SO3 | 品红 | 红色变无色 |
| D | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com