(1)现在的生活条件好了,节假日中可供选择的物品更多了,人们在购买年货时也更加关注自身的健康的需要了.
①鸡蛋中的蛋白质在人体中水解最终转化成
氨基酸
氨基酸
.
②食品添加剂亚硝酸钠的外观像食盐,并有咸味,但亚硝酸钠有很强的毒性.亚硝酸钠属于
防腐剂
防腐剂
(选填“调味剂”、“防腐剂”或“着色剂”).
③维生素C也称抗坏血酸.血液中运载氧的血红蛋白中含有Fe
2+,人之所以患坏血病,是因为人体从摄取的食物中吸收的铁主要是Fe
3+,Fe
3+不能被人体吸收.人们多吃一些新鲜水果、绿色蔬菜就能有效防止坏血病的发生,这是因为
新鲜水果、绿色蔬菜中含有丰富维生素C把Fe3+还原为Fe2+
新鲜水果、绿色蔬菜中含有丰富维生素C把Fe3+还原为Fe2+
.
④市场上销售的食盐品种很多.下列食盐中,所添加的元素不属于人体必需微量元素的是
C
C
(填字母).
A.加锌盐 B.加碘盐 C.加钙盐
⑤纤维素被称为“第七营养素”.食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质.从化学成分看,纤维素是一种
A
A
(填字母).
A.多糖 B.蛋白质 C.脂肪
(2)材料是人类赖以生存和发展的重要物质基础.
①生产硅酸盐水泥和普通玻璃都需用到的共同的主要原料是
石灰石
石灰石
.
②生活中有大量的铝制品.家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示)
Al2O3+2OHˉ=2AlO2ˉ+H2O(或2Al+2OHˉ+2H2O=2AlO2ˉ+3H2↑)
Al2O3+2OHˉ=2AlO2ˉ+H2O(或2Al+2OHˉ+2H2O=2AlO2ˉ+3H2↑)
.
③有机玻璃受热时会软化,易于加工成型.有机玻璃是一种
塑料
塑料
材料(选填“硅酸盐”或“纤维”或“塑料”).
④生铁是用量最多的合金材料,合金的熔点一般比成分金属的熔点
低
低
(填“高”或“低”).
(3)保护环境、保护地球是人类共同的呼声.
①向煤中加入石灰石作为脱硫剂,可以减少煤燃烧时产生的SO
2.发生反应的化学方程式为
2CaCO
3+O
2+2SO
22CaSO
4+2CO
22CaCO
3+O
2+2SO
22CaSO
4+2CO
2.
②水中含有的悬浮颗粒物等杂质,可以加入
明矾
明矾
等混凝剂进行净化处理.工业废水中含有的Cr
3+离子,可用熟石灰作沉淀剂,在pH为8~9时生成沉淀而除去,该反应的离子方程式是
Cr3++3OH-=Cr(OH)3↓
Cr3++3OH-=Cr(OH)3↓
.
③城市餐饮业会产生大量污染环境的“地沟油”.“地沟油”的主要成分是油脂.综合利用“地沟油”的一种方法是将“地沟油”中的油脂水解以获取甘油和
高级脂肪酸
高级脂肪酸
.生活中会产生大量废弃塑料,将废弃塑料进行
裂解
裂解
处理,可以获得乙烯、丙烯等化工原料.

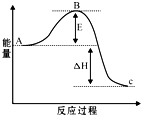 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
