
(12分)
(1)20℃时0.1 mol·L-1NaOH分别滴定0.1 mol·L-1HCl、0.1 mol·L-1CH3COOH的pH变化曲线如下。
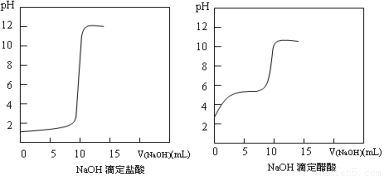
根据上述曲线回答下列问题:
①测得醋酸起点pH为3,则20℃时该浓度醋酸的电离度为 ;
②滴定开始后醋酸曲线变化比盐酸快的原因是 ;
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为 (填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
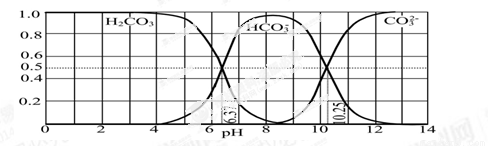
①下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3·H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
(1)1% 醋酸是弱酸,中和生成的醋酸根离子对醋酸电离产生抑制 (2)NaHR (3)CD (4)
① 碱 由于NH3·H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-) > c(H+),溶液呈碱性 ② A、C、D
【解析】
试题解析:(2)①根据图象可知0.1mol?L-1的醋酸,其PH为3,所以c(H+)=10-3mol/L,故电离度=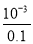 ×100%=1%;②醋酸是弱酸,醋酸与氢氧化钠反应生成CH3COO-;使电离平衡逆移CH3COOH?CH3COO-+H+,故H+ 浓度变化比较快,故答案为:醋酸是弱酸,中和反应生成的醋酸根离子对醋酸的电离产生抑制;(2)25℃时0.1mol?L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液,溶液中存在c(Na+)=c(R2-)+c(HR-)+c(H2R),说明钠原子和R原子以1:1存在于盐溶液中,R形成的酸为二元酸,所以该溶质为二元酸的酸式盐,即NaHR,故答案为:NaHR;(3)①A.1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液,在碳酸浓度达到饱和之前,碳酸浓度应逐渐增大,且起始浓度不可能为1.0mol/L,故A错误;B.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),但三者的浓度不相等,故B错误;C.由图可知,pH为7.4时,HCO3-的最大,则当人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在,故C正确;D.溶液的pH为7~9之间时,溶液中的阴离子主要以HCO3-形式存在,所以溶液中的溶质主要为碳酸氢钠,故D正确;故选CD;(4)①分析电离平衡常数可知电离程度,NH3?H2O>H2CO3>HCO3-,对应盐水解程度NH4+<HCO3-<CO32-,常温下0.1mol?L-1的(NH4)2CO3溶液呈碱性,由于NH3?H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性;②A.溶液中铵根离子浓度大于碳酸根离子浓度,碳酸根离子水解程度大于铵根离子水解程度,所以溶液中离子浓度大小为:c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3?H2O),故A正确;B.溶液中存在电荷守恒为:c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故错误;C.依据溶液中物料守恒得到:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol?L-1 ,故C正确;D.依据溶液中物料守恒,n(N):n(C)=2:1,结合溶液中离子种类和守恒关系得到:c(NH4+)+c(NH3?H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D正确;故答案为:ACD.
×100%=1%;②醋酸是弱酸,醋酸与氢氧化钠反应生成CH3COO-;使电离平衡逆移CH3COOH?CH3COO-+H+,故H+ 浓度变化比较快,故答案为:醋酸是弱酸,中和反应生成的醋酸根离子对醋酸的电离产生抑制;(2)25℃时0.1mol?L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液,溶液中存在c(Na+)=c(R2-)+c(HR-)+c(H2R),说明钠原子和R原子以1:1存在于盐溶液中,R形成的酸为二元酸,所以该溶质为二元酸的酸式盐,即NaHR,故答案为:NaHR;(3)①A.1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液,在碳酸浓度达到饱和之前,碳酸浓度应逐渐增大,且起始浓度不可能为1.0mol/L,故A错误;B.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),但三者的浓度不相等,故B错误;C.由图可知,pH为7.4时,HCO3-的最大,则当人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在,故C正确;D.溶液的pH为7~9之间时,溶液中的阴离子主要以HCO3-形式存在,所以溶液中的溶质主要为碳酸氢钠,故D正确;故选CD;(4)①分析电离平衡常数可知电离程度,NH3?H2O>H2CO3>HCO3-,对应盐水解程度NH4+<HCO3-<CO32-,常温下0.1mol?L-1的(NH4)2CO3溶液呈碱性,由于NH3?H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性;②A.溶液中铵根离子浓度大于碳酸根离子浓度,碳酸根离子水解程度大于铵根离子水解程度,所以溶液中离子浓度大小为:c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3?H2O),故A正确;B.溶液中存在电荷守恒为:c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故错误;C.依据溶液中物料守恒得到:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol?L-1 ,故C正确;D.依据溶液中物料守恒,n(N):n(C)=2:1,结合溶液中离子种类和守恒关系得到:c(NH4+)+c(NH3?H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D正确;故答案为:ACD.
考点:中和滴定;盐类的水解


科目:高中化学 来源:2014-2015学年安徽省江南十校高三上学期期末联考理综化学试卷(解析版) 题型:选择题
纳米钴(Co)加氢反应的催化剂,500K时催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) △H<0。有关说法正确的是
CH4(g)+H2O(g) △H<0。有关说法正确的是
A.纳米技术的应用,提高了催化剂的催化性能,但平衡常数不变
B.缩小容器体积,平衡向正反应方向移动CO的浓度减小
C.温度越低,越有利于CO催化加氢
D.从平衡体系中分H2O(g)能加快正反应速率
查看答案和解析>>
科目:高中化学 来源:2015年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.NH4HCO3溶液中加入少量稀NaOH溶液:NH4++ OH-=NH3·H2O
B.FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C.硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2=Fe3++2H2O
D.在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O=3H++2Br-+SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省协作体高三上学期第二次月考化学试卷(解析版) 题型:填空题
(16分)某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式为

为推测X的分子结构,进行如下图的转化:

已知向E的水溶液中滴入FeCl3溶液发生显色反应;M(C2H2O4)能使蓝墨水褪色;G、M都能与NaHCO3溶液反应。
请回答:
(1)M的结构简式为_____________;G分子所含官能团的名称是______________。
(2)E可以发生的反应有(选填序号)___________。
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)由B转化成D的化学方程式是________________________。
(4)G在一定条件下发生反应生成分子组成为C4H4O4的有机物(该有机物可使溴的四氯化碳溶液褪色),写出G发生此反应的化学方程式是__________________。
(5)已知在X分子结构中,I里含有能与FeCl3溶液发生显色反应的官能团,且E分子中苯环上的一氯代物只有一种,则X的结构简式是:___________________。
(6)F与G互为同分异构体,F的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基。则F的分子结构有________种。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省协作体高三上学期第二次月考化学试卷(解析版) 题型:选择题
下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化

下列叙述正确的是
A.产生气体体积 ①=②
B.①中阴极质量增加,②中正极质量减小
C.溶液的pH变化:①减小,②增大
D.电极反应式:①中阳极:4OH- - 4e- = 2H2O+O2↑ ②中负极:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:选择题
某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:①取少量溶液加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5 mL0.2 mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失。
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g。
下列说法中正确的是:
A.该溶液中一定不含Ba2+ 、Mg2+、A13+、SiO32-、Cl-
B.该溶液中一定含有K+、AlO2-、CO32-、Cl-
C.该溶液是否有K+ 需做焰色反应(透过蓝色钴玻璃片)
D.可能含有Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:选择题
下列判断错误的是
A.酸性:HClO4>H2SO4>H3PO4 B.沸点:NH3>PH3>AsH3
C.熔点:Si3N4>NaCl>SiI4 D.碱性:NaOH>Mg(OH)2>Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:填空题
(8分)现有X、Y、Z、M四种元素均为短周期元素。有关信息如下表:
原子或分子结构、单质或化合物相关信息 | |
X | 含X元素的物质焰颜色反应为黄色 |
Y | 单质为双原子分子。若低温蒸发液态空气,因其沸点较低可先获得Y的单质 |
Z | Z元素原子易失去2个电子形成8电子结构的离子 |
M | M元素原子的最外层电子数是K层电子数的3倍,M与X处于同一周期 |
(1)X元素在周期表的位置是 ;
(2)1个Y单质分子中含 对个共用电子对;
(3)Z能在CO2气体中燃烧,其化学反应方程式为 。
(4)化合物X2M溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质X2M2,其溶液显黄色.则X2M2的电子式为 ,用化学方程式表示X2M溶液在空气中的变质过程 .
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市高三1月调研理综化学试卷(解析版) 题型:填空题
(15分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol·L-1的溶液中缓慢滴加稀氨水,产生沉淀的先后顺序为 (用化学式表示)。
(2)实验室制备氨气的化学方程式为 。
工业上,制备肼(N2H4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应。以石墨为电极,将该反应设计成原电池,该电池的负极反应为 。
(3)在3 L密闭容器中,起始投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
温度(K) | 平衡时NH3的物质的量(mol) |
T1 | 2.4 |
T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。若再增加氢气浓度,该反应的平衡常数将 (填“增大”、“减小”或“不变”)。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com