
| A. | 1mol Na2O2固体中含有O22- 2NA | |
| B. | 常温常压下,3.2g CH4中含有电子2NA | |
| C. | 标准状况下,11.2L CH3CH2OH中含有分子0.5NA | |
| D. | 100mL 1mol•L-1的CH3COOH溶液中含有CH3COOH分子0.1NA |
分析 A.1mol过氧化钠中含有1mol过氧根离子;
B.甲烷分子中含有10个电子,根据n=$\frac{m}{M}$计算出甲烷的物质的量,再计算出含有的电子数;
C.标准状况下,乙醇的状态不是气体;
D.醋酸为弱电解质,在溶液中部分电离,则溶液中的醋酸分子减少.
解答 解:A.1mol过氧化钠中含有1mol过氧根离子,含有O22-数目为NA,故A错误;
B.3.2g甲烷的物质的量为:$\frac{3.2g}{16g/mol}$=0.2mol,0.2mol甲烷中含有电子的物质的量为:0.2mol×10=2mol,含有的电子数为2NA,故B正确;
C.标况下乙醇不是气体,不能使用标况下的气体摩尔体积计算,故C错误;
D.100mL 1mol•L-1的CH3COOH溶液中含有溶质醋酸的物质的量为0.1mol,由于醋酸部分电离,则溶液中含有CH3COOH分子数小于0.1NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,明确标况下乙醇、水、四氯化碳等物质的状态不是气态.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NO2、SO2、BF2、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构 | |
| B. | CCl4和NH3都是以极性键结合的极性分子,P4和NO2都是共价化合物 | |
| C. | 在CaO和SiO2晶体中,都不存在单个小分子 | |
| D. | π键是由两个p电子“头碰头”重叠形成,σ键是镜面对称,而π键是轴对称 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,CH3COONa和CH3COOH混合溶液中[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| B. | 在O.1mol•L-1Na2C03溶液中:cc(Na+)=2c(CO32-) | |
| C. | 在O.1mol•L-1NaHC03溶液中:c(HCO3-)>c(CO32-)>c(H2C03) | |
| D. | 向0.2mol•L-1NaHC03溶液中加入等体积O.1mol•L-1NaOH溶液:c(CO32-)+c(HCO3-)+c(OH-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
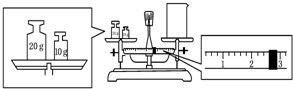 实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液250mL:
实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液250mL:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
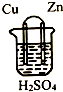
| A. | 铜片作正极,锌片作负极 | |
| B. | 该电池工作时,锌失电子变为Zn2+进入溶液 | |
| C. | 该电池工作时,电子由铜片流向锌片 | |
| D. | 该电池工作时,H+在铜片上得电子被还原生成H2逸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com