
(5分)短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍。
(1)W在周期表中的位置是 。
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为 。
(3)X、Y、Z三种元素组成的化合物中存在的化学键类型为 。
(4)Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为 。
(1)第三周期 第ⅦA族(1分) (2)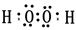 (1分)
(1分)
(3)离子键、共价键(2分) (4)H++OH-=H2O(1分)
解析试题分析:短周期元素X、Y、Z、W核电荷数依次增大,在周期表中X是原子半径最小的元素,则X为氢元素;Y的最外层电子数是内层电子数的3倍,Y元素元素有2个电子层,最外层电子数为6,故Y为氧元素;X、Z同主族,处于第ⅠA族,Z的原子序数大于氧元素,故Z为Na元素;四种元素的原子序数之和为37,故W的原子序数为37-11-8-1=17,故W为Cl元素,则
(1)Cl元素原子有3个电子层,最外层电子数为7,处于第三周期第ⅦA族;
(2)X与Y 能形成具有18个电子的化合物为H2O2,H2O2分子中氧原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对,电子式为: ;
; (3)H、O、Na三种元素组成的化合物为NaOH,属于离子化合物,由钠离子与氢氧根离子构成,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,故NaOH中存在离子键、共价键;
(3)H、O、Na三种元素组成的化合物为NaOH,属于离子化合物,由钠离子与氢氧根离子构成,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,故NaOH中存在离子键、共价键;
(4)NaOH与高氯酸反应生成高氯酸钠与水,反应离子方程式为:H++OH-=H2O。
考点:考查结构位置性质关系、常用化学用语、化学键等


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
A、B、C均为短周期元素,A、B同周期, A、C的最低价离子分别为A2- 和C-,B2+ 和C-具有相同的电子层结构,下列说法中正确的是 ( )
A. C元素的最高正价为+7价 B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.还原性:A2-<C-
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属。试回答:
(1)C在元素周期表的第_____周期________族。
(2)在五种元素中,能形成的最简单的液态或气态氢化物的稳定性由大到小的顺序是(用具体的分子式表示) 。
(3)A与B形成的三原子分子的结构式是 ,B与D形成的原子个数比为1∶1的化合物的电子式是 。
(4)E的一种氢化物叫肼,其分子中E原子与氢原子个数比为1 :2。肼—空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%—30%的KOH溶液。该燃料电池的正极的电极反应式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)上述十种元素中,最高价氧化物水化物酸性最强的化合物的化学式是 ,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是 ,最高价氧化物水化物显两性的氢氧化物的化学式是 。
(2)③与④的气态氢化物的稳定性由大到小的顺序是 。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
五种短周期元素D、E、F、X、Y、Z的原子序数依次增大,D、E两元素最高正价与最低负价之和均为0,E元素的一种同位素常用于考古断代,D和X同主族,F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,X和Z形成的二元化合物是厨房常用的调味品。回答下列问题:
(1)①E元素在元素周期表中的位置是_______________。
②由D和F,Y,Z所形成的最简单常见共价型化合物中,热稳定性最差的是__________(用化学式表示,下同);还原性最强的是_____________。
③F、X、Z形成的简单离子半径从大到小顺序为_________________(用离子符号表示)
④D、F、Z形成一种离子化合物,写出它的电子式________________________。
(2)①2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是____________。
②F、X形成的一种二元离子化合物具有非常强的爆炸性,该物质中X的质量分数是35.38%,,则该物质的化学式为___________。
③Z单质和FD3发生置换反应,观察到有大量白烟生成,写出该反应化学方程式__________,反应中氧化剂和还原剂物质的量之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)现有1—20号元素A、B、C、D所对应的物质的性质或微粒结构如下:
①A的原子,M层上有6个电子。②B的离子与D的离子具有相同电子层结构,且可以相互组合形成常见干燥剂。③元素C,常温下单质为双原子分子,其氢化物水溶液呈碱性④元素D,最高正价为+7价。请回答下列问题
(1)B的离子与D的离子相互组合形成的干燥剂的化学式是 。
(2)元素C与氢元素形成带一个单位正电荷的离子,写出该微粒的电子式(用元素符号表示) 。
(3)元素A与元素D相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下A的单质和D的单质状态不同 b.A的氢化物比D的氢化物稳定
c.一定条件下D单质能从A的氢化物水溶液中置换出A单质
d.HD的酸性比HA酸性强
C的氢化物固态时属于 晶体,该氢化物与A的最高价氧化物水化物反应的化学方程 式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ. A、B、C、D、E、F、G七种元素,试按下列所给条件推断,
①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C;
②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质是液体,E的单质是固体
③F在常温下是气体,性质稳定,是除氢气外最轻的气体
④G是除氢外原子半径最小的元素
(1)A 的名称是 ,B位于周期表中第 周期第 族。
(2)C的原子结构示意图是 ,
A元素与D元素形成化合物的电子式是 。
(3)F的元素符号是 。
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ,酸性最强的化学式是 ,气态氢化物最稳定的化学式是 。
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方程式是
。
Ⅱ、(1)下表中的实线表示元素周期表部分边界,请用实线画出周期表未完成的边界及金属元素与非金属元素的分界线。
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)下表是元素周期表的一部分,请回答有关问题: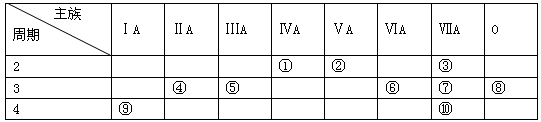
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式 。
(3)①、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(4)③元素与⑩元素两者核电荷数之差是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com