
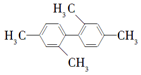
| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 分子中至少有11个碳原子处于同一平面上 | |
| D. | 该烃属于苯的同系物 |
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
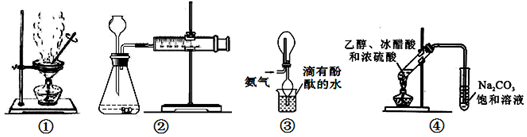
| A. | 装置①可用于“海带提碘”实验中将海带灼烧成灰 | |
| B. | 装置②可用于H2O2分解速率的测定 | |
| C. | 装置③可用于氨气的收集 | |
| D. | 装置④可用于实验室制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 整个反应过程中,铜相当于催化剂 | |
| C. | 通空气时,铜被氧化,表面产生Cu2O | |
| D. | Li电极减轻7g时,至少需消耗空气5.6L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| B. | 海轮船体镶嵌锌块是牺牲阳极的阴极保护法,防止船体被腐蚀 | |
| C. | 氢氧化铝和碳酸钠均可用于治疗胃酸过多 | |
| D. | 食用油反复加热会产生稠环芳烃等有害物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
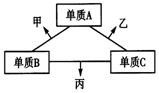 A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍.A、B、C三种元素的单质在适当条件下可发生如图所示的变化.下列说法不正确的是( )
A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍.A、B、C三种元素的单质在适当条件下可发生如图所示的变化.下列说法不正确的是( )| A. | 甲、乙、丙三种物质的水溶液均显碱性 | |
| B. | 单质A、C均存在同素异形体 | |
| C. | 甲、乙可能都其有漂白性 | |
| D. | 丙的水溶液在空气中长期放置,溶液可能会变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com