
 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取漂白粉,据此回答下列问题:
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取漂白粉,据此回答下列问题: MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O CaCl2+Ca(ClO)2+2H2O
CaCl2+Ca(ClO)2+2H2O分析 (1)加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气;
(2)氯气与碱石灰反应生成氯化钙、次氯酸钙、水;
(3)氯气有毒不能排放在环境中;
(4)酸性条件下生成HClO,漂白性增强.
解答 解:(1)加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气,发生MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)因氯气与碱石灰反应生成氯化钙、次氯酸钙和水,化学反应方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;
(3)因氯气有毒,则装置C的作用为吸收未完全反应的氯气,防止污染空气,故答案为:吸收多余的CI2,防止污染空气;
(4)酸性条件下生成HClO,漂白性增强,只有D符合,A为中性,B、C为碱性,
故答案为:D.
点评 本题考查氯气的化学性质、氯气的实验室制法、尾气的处理等知识点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 3molH2+1molN2 | B. | 2molNH3+1molN2 | ||
| C. | 2molN2+3molH2 | D. | 0.1molNH3+0.95molN2+2.85molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
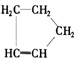 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 .环戊烯的化学性质跟烯烃相似.
.环戊烯的化学性质跟烯烃相似.
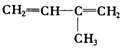 )臭氧分解各种产物的结构简式及物质的量之比:HCHO、
)臭氧分解各种产物的结构简式及物质的量之比:HCHO、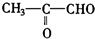 ;2:1.
;2:1. )合成乙二醛(
)合成乙二醛(  )的各步合成路线流程.
)的各步合成路线流程.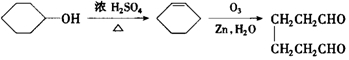 .
.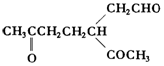 .A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.请写出A和B的结构简式(不必注明名称).
.A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.请写出A和B的结构简式(不必注明名称). ,B是
,B是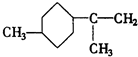 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和CO的混合气 | B. | C2H2O2 | C. | C3H6O3 | D. | C6H12O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
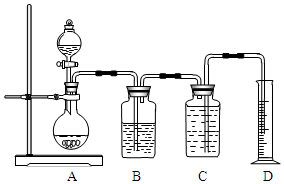 如图所示装置可用于多种实验.
如图所示装置可用于多种实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白精的主要成分是次氯酸钙 | B. | 漂白精露置在空气中会失效 | ||
| C. | 漂白精水溶液具有漂白性 | D. | 漂白精杀菌效果随pH降低而增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com