
| A. | c(H+)=$\sqrt{{K}_{W}}$的溶液一定呈中性 | |
| B. | 金属钠、镁着火时可用泡沫灭火器扑灭 | |
| C. | 用玻璃棒蘸取待测液于湿润的pH试纸上测pH 值 | |
| D. | 常温下1L PH=13的Ba(OH)2溶液中含有0.2NA个OH- 离子 |
分析 A.根据Kw=c(H+)•c(OH-)计算;
B.根据过氧化钠、镁与二氧化碳反应的性质判断;
C.用pH试纸测pH 值时,试纸不能湿润;
D.PH=13的Ba(OH)2溶液中c(OH- )=0.1mol/L.
解答 解:A.根据Kw=c(H+)•c(OH-),c(OH-)=$\sqrt{{K}_{W}}$的溶液则c(OH-)=c(H+),溶液一定呈中性,故A正确;
B.钠燃烧生成过氧化钠,过氧化钠、镁都与二氧化碳反应,不能用二氧化碳灭火,应用沙土盖灭,故B错误;
C.用pH试纸测pH 值时,试纸不能湿润,若试纸被湿润,则会被稀释溶液的浓度减小,故C错误;
D.PH=13的Ba(OH)2溶液中c(OH- )=0.1mol/L,1L PH=13的Ba(OH)2溶液中含有0.1NA个OH- 离子,故D错误.
故选A.
点评 本题考查较为综合,涉及钠、镁的性质、pH试纸的使用、pH的计算以及物质的量的计算等知识,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意相关基础知识的积累,难度中等.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
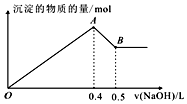 现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )| A. | 1:3 | B. | 3:1 | C. | 2:3 | D. | 6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
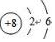 .A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)
.A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示) _.
_.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )| A. | Be、Na、Al | B. | C、Al、P | C. | O、P、Cl | D. | B、Mg、S |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
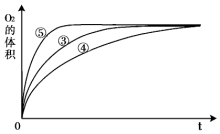 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com