


 MnCl2++Cl2↑+2H2O,
MnCl2++Cl2↑+2H2O, MnCl2++Cl2↑+2H2O;
MnCl2++Cl2↑+2H2O; MnCl2++Cl2↑+2H2O可知,若用
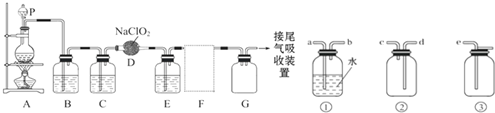
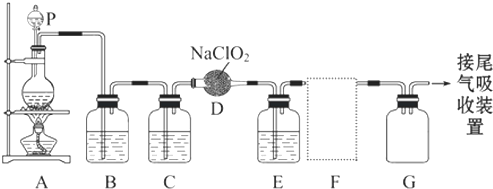
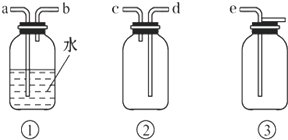
MnCl2++Cl2↑+2H2O可知,若用 MnCl2++Cl2↑+2H2O,经除杂、干燥后在D中亚氯酸钠固体反应生成ClO2,由于Cl2易溶于CCl4液体,E用于除去ClO2中的未反应的Cl2,最后用向上排空法收集;并注意气体的性质和装置来分析防止倒吸的装置,利用稀盐酸与二氧化锰不反应来分析浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量.
MnCl2++Cl2↑+2H2O,经除杂、干燥后在D中亚氯酸钠固体反应生成ClO2,由于Cl2易溶于CCl4液体,E用于除去ClO2中的未反应的Cl2,最后用向上排空法收集;并注意气体的性质和装置来分析防止倒吸的装置,利用稀盐酸与二氧化锰不反应来分析浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省滨州市沾化二中高一(下)学分认定化学试卷(解析版) 题型:解答题
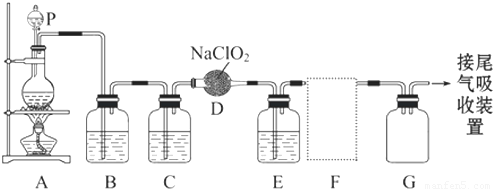
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省周口市鹿邑二中高一(下)尖子生对抗赛第二期化学试卷(解析版) 题型:解答题
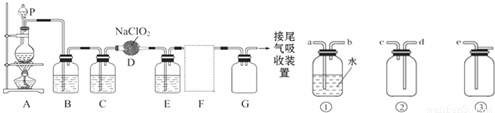
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com