

分析 (1)依据硫化钠溶液中硫离子水解显碱性的水解平衡影响因素分析判断;
(2)①ZnCO3与Na2S反应生成硫化锌和一氧化碳;
②滴定终点为溶液由蓝色变为无色,且半分钟内不变色;
③根据I2~2Na2S2O3•5H2O可得n(Na2S2O3•5H2O)=2n(I2),步骤b与c中样品用来相同,则可得到步骤c中Na2S2O3消耗的碘,再根据多余的碘结合I2~Na2S•9H2O可知Na2S的物质的量,再由质量分数=$\frac{物质的质量}{样品的质量}×100%计算$可得.
解答 解:(1)上述流程中采用稀碱液比用热水更好,硫化钠溶液中硫离子水解显碱性,水解过程是吸热反应,加热促进水解进行,稀碱溶液能起到抑制水解的作用;
故答案为:热水会促进Na2S水解,而稀碱液能抑制Na2S水解;
(2)①ZnCO3除去Na2S的离子方程式为:ZnCO3+S2-═ZnS+CO,故答案为:ZnCO3+S2-═ZnS+CO;
②滴定终点为:溶液由蓝色变为无色,且半分钟内不变色,故答案为:溶液由蓝色变为无色,且半分钟内不变色;
③步骤b中消耗的I2有:
n(I2)=0.050 00 mol•L-1×5.00 mL×10-3 L•mL-1=2.500×10-4 mol
n(Na2S2O3•5H2O)=2n(I2)=5.000×10-4 mol
w(Na2S2O3•5H2O)=$\frac{5×1{0}^{-4}mol×248g/mol}{0.5g}$×100%=24.8%
步骤c中,加入的I2有:
n(I2)=0.050 00 mol•L-1×50.00 mL×10-3 L•mL-1=2.500×10-3 mol
由步骤b可知25mL溶液中Na2S2O3消耗的I2有:2.500×10-4 mol
滴入的标准Na2S2O3溶液消耗多余的I2有:15.00 mL×10-3 L•mL-1×0.100 0 mol•L-1×=7.500×10-4 mol
溶液中Na2S有:
n(Na2S•9H2O)=n(Na2S)=(2.500×10-3-2.500×10-4-7.500×10-4)mol=1.500×10-3 mol
w(Na2S•9H2O)=$\frac{1.5×1{0}^{-3}mol×240g/mol}{0.5g}$×100%=72.0%
答:试样中Na2S•9H2O的质量分数为72%,Na2S2O3•5H2O的质量分数为24.8%.
点评 本题是物质制备的考查题,主要是温度对水解平衡的影响,化学方程式书写方法,氧化还原反应滴定的计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
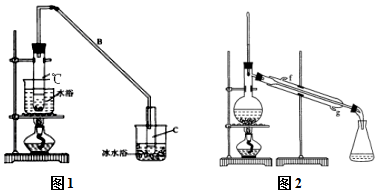 某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯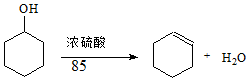
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量的NH3(g):Ag+、NH4+、NO3-、OH- | |
| B. | 加入过量 HNO3(aq):NH4+、Ag+、H+、NO3- | |
| C. | 通入过量 HCl(g):NH4+、H+、Cl-、NO3- | |
| D. | 加入过量NaOH(aq):NH4+、Na+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
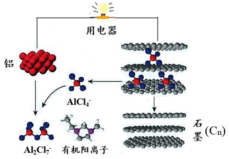 近期,科学家成功研制出一种可在一分钟内完成充放电的超常性能铝离子电池.该电池内部的A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
近期,科学家成功研制出一种可在一分钟内完成充放电的超常性能铝离子电池.该电池内部的A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 充电时,A1Cl4-向石墨电极移动 | |
| C. | 放电时,负极的电极反应式为A1十7A1Cl4--3e-=4 A12Cl7- | |
| D. | 充电时,电子从石墨电极直接经导线流入铝电极,然后再经电解质溶液流回石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O
氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中,每生成2 mol AlN需转移6 mol电子 | |
| C. | AlN中氮元素的化合价为+3 | |
| D. | AlN的摩尔质量为41 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 应用 |
| A | Na2O2与水、CO2反应 | 潜水艇O2的来源 |
| B | 单质镁有强还原性 | 镁合金作飞机材料 |
| C | 次氯酸及其盐具有漂白性 | 净化饮用水 |
| D | 铜不与O2反应 | 制备铜币 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
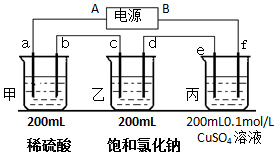 用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则
用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则查看答案和解析>>
科目:高中化学 来源: 题型:选择题
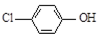 ),同时利用此装置的电能在铁上镀铜,下列说法正确的是( )
),同时利用此装置的电能在铁上镀铜,下列说法正确的是( )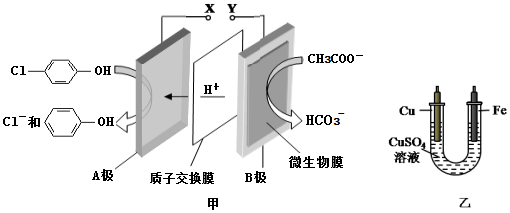
| A. | 当外电路中有0.2 mole-转移时,A极区增加的H+的个数为0.1 NA | |
| B. | A极的电极反应式为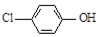 +e-=Cl-+ +e-=Cl-+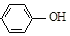 | |
| C. | 铁电极应与Y相连接 | |
| D. | 反应过程中甲中右边区域溶液pH逐渐升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com