
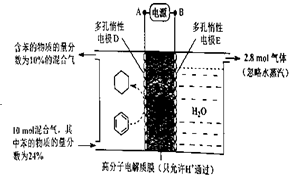
分析 ①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是分解、B是正极,电子从负极流向正极;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷;
③阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷,苯参加反应需要电子的物质的量与总转移电子的物质的量之比就是电流效率η.
解答 解:①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是分解、B是正极,电子从负极流向阴极,所以电子从A流向D,故答案为:A→D;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,故答案为:C6H6+6H++6e-=C6H12;
③阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气,转移电子的物质的量=2.8mol×4=11.2mol,生成1mol氧气时生成2mol氢气,则生成2.8mol氧气时同时生成5.6mol氢气,设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×24%-xmol,反应后苯的含量$\frac{10mol×24%-x}{10mol-3xmol+5.6mol}$×100%=10%,x=1.2,苯转化为环己烷转移电子的物质的量为1.2mol×6=7.2mol,则 $\frac{7.2mol}{11.2mol}$×100%=64.3%,故答案为:64.3%.
点评 本题考查了电解池原理等知识点,根据电解原理等知识点来分析解答,注意:10mol×(24%-10%)不是参加反应的苯的物质的量,为易错点.


科目:高中化学 来源: 题型:选择题
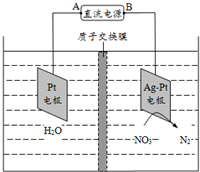
| A. | 电源的正极为b | |
| B. | 电解时H+从膜右侧迁移到膜左侧 | |
| C. | Ag-Pt电极反应为:2H2O-4e-=4H++O2↑ | |
| D. | 若转移的电子数为1.204×1024,生成N25.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质失电子的反应为氧化反应 | |
| B. | 物质在变化中失去了电子,此物质是氧化剂 | |
| C. | 发生电子转移的反应即是氧化还原反应 | |
| D. | 发生化合价升降的反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(A)>r(B)>r(D)>r(C) | B. | 离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) | ||
| C. | 原子序数:d>c>b>a | D. | 单质的还原性:A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VⅠA | VⅡA |
| 2 | a | b | c | ||||
| 3 | d | e | f | g | h | i |
| A. | a、b、e、f四种元素的原子半径:e>f>b>a | |
| B. | h、i两种元素阴离子的还原性:h>i | |
| C. | a、g两种元素氢化物的稳定性:g>a | |
| D. | d、e、f三种元素最高价氧化物对应的水化物的碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该硫铁矿含FeS2也是48% | B. | 硫损失也是2% | ||
| C. | 铁损失也是2% | D. | 该硫铁矿含铁42% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com