二甲醚(CH
3OCH
3)和甲醇(CH
3OH)被称为21世纪的新型燃料.以CH和H
2O为原料制备二甲醚和甲醇的工业流程如下:请回答下列有关问题:
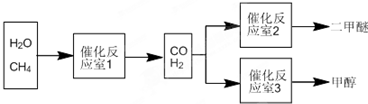
(1)在一定条件下,催化反应室1中发生反应:CH
4(g)+H
2O(g)?CO(g)+3H
2(g)△H<0.在其它条件不变的情况下降低温度,逆反应速率将
(填“增大”、“减小”或“不变”).将1mol CH
4和2mol H
2O通入催化反应室1(假设容积为100L),10min末有0.1mol CO生成,则10min内反应的平均速率v(H
2)=
.在催化反应室3中(假设容积为V L)发生反应:CO(g)+2H
2(g)?CH
3OH(g)△H=-Q kJ?mol
-1.
①将a mol CO与2a mol H
2通入催化反应室3,则反应达到平衡时,放出热量
(大于,小于,等于) 2aQ kJ.
②一定条件下的密闭容器中,该反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母编号).
a.高温高压 b.加入催化剂 c.增加H
2的浓度d.增加CO的浓度 e.分离出甲醇
③在一定条件下,若CO的平衡转化率为50%,此反应的平衡常数K=
(用含a、V的代数式表示).
(3)二甲醚(CH
3OCH
3)也是一种重要的清洁燃料,可替代氟利昂作制冷剂等,对臭氧层无破坏作用.利用甲醇可以合成二甲醚,反应原理为:2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g).某温度下此反应的平衡常数为400.此温度下,在密闭容器中加入CH
3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
若加入CH
3OH后,经10min反应达到平衡,此时CH
3OH的转化率为
,体系CH
3OCH
3的体积分数
(计算结果保留三位有效数字).




 在如图所示的装置中,溶液的体积均为1L,浓度均为0.1mol?L-1.工作一段时间后,测得电路中均通过了0.02mol e-.下列叙述中正确的是( )
在如图所示的装置中,溶液的体积均为1L,浓度均为0.1mol?L-1.工作一段时间后,测得电路中均通过了0.02mol e-.下列叙述中正确的是( )