
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源:不详 题型:单选题
 2C (g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示。下列说法正确的是
2C (g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示。下列说法正确的是
| A.30 min时降低温度,40 min时升高温度 |
| B.反应方程式中x=1,正反应为放热反应 |
| C.该反应在第8 min时达到化学平衡状态 |
| D.30~40 min间该反应使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na与无水乙醇反应时增大无水乙醇的用量 |
| B.Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸 |
| C.在K2SO4与BaCl2两溶液反应时,增大压强 |
| D.将炭块磨成炭粉用于燃烧 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增加A的物质的量 | B.升高体系的温度 |
| C.减少C的物质的量 | D.增加体系的压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(s)+4D(g),△H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。若使曲线b变为曲线a,可采取的措施是( )
C(s)+4D(g),△H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。若使曲线b变为曲线a,可采取的措施是( )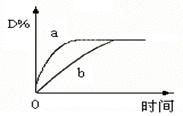
| A.升高温度 | B.缩小反应容器的体积 |
| C.增加C的质量 | D.减小B的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ?2B(g)+C(g) ⊿H> 0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是
?2B(g)+C(g) ⊿H> 0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是| A.减压 | B.降温 | C.加压 | D.增大B的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.改用98%的浓硫酸 | B.改用铝粉 |
| C.改加入2 mol/L的稀硫酸100 mL | D.加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.10℃时,块状锌与3 mol/L硫酸溶液反应 |
| B.30℃时,粉末状锌与3 mol/L硫酸溶液反应 |
| C.10℃时,粉末状锌与3 mol/L硫酸溶液反应 |
| D.30℃时,块状锌与3 mol/L硫酸溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com