
| A. | c(Na+)=2c(CO32-) | B. | c(H+)>c(OH-) | C. | c(CO32-)>c(HCO3-) | D. | c(CO32-)>c(OH-) |
分析 A.Na2CO3为强碱弱酸盐,碳酸根离子水解,c(Na+)>2c(CO32-);
B.Na2CO3为强碱弱酸盐,碳酸根离子水解,溶液呈碱性;
C.Na2CO3为强碱弱酸盐,电离为主,水解程度相对较小;
D.Na2CO3 为强碱弱酸盐,CO32-水解导致溶液呈碱性,但电离为主,水解生成的氢氧根离子浓度较小.
解答 解:A.Na2CO3为强碱弱酸盐完全电离:Na2CO3 =2Na++CO32-,碳酸根离子水解,CO32-+H2O?HCO3-+OH-,所以c(Na+)>2c(CO32-),故A错误;
B.CO32-水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,溶液中c(H+)<c(OH-)呈碱性,故B错误;
C.Na2CO3为强碱弱酸盐完全电离:Na2CO3 =2Na++CO32-,碳酸根离子水解,CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,电离为主,水解程度相对较小,所以c(CO32-)>c(HCO3-),故C正确;
D.Na2CO3 为强碱弱酸盐,CO32-水解导致溶液呈碱性,但电离Na2CO3 =2Na++CO32-为主,CO32-水解程度较小,水解生成的氢氧根离子浓度较小,所以溶液中离子浓度大小顺序是c(CO32-)>c(OH-),故D正确;
故选CD.
点评 本题考查离子浓度大小比较,明确物质的性质和掌握盐类水解的规律是解本题关键,注意可溶性盐的电离大于弱根离子的水解,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 原子半径:Br>Se | |
| B. | 还原性:H2Se>HBr | |
| C. | Se在元素周期表中位于第四周期第六族 | |
| D. | 在Se2Br2分子中只含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
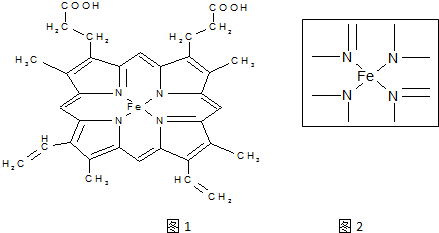
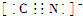 ,1mol O22+中含有的π键数目为2NA.
,1mol O22+中含有的π键数目为2NA.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 |
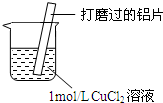 | ⅰ.红色物质附着于铝片表面 ⅱ.大量无色气体从红色物质表面逸出,放出大量的热 ⅲ.烧杯底部出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应2CO(g)→2C(s)+O2(g);△H>0不能自发进行,加入适当的催化剂可以自发 | |
| B. | 粗铜电解精炼时,阳极减少的质量与阴极增加的质量一定相同 | |
| C. | 体积均为10mL pH均为2的盐酸与醋酸,分别加入0.1g Zn,最终醋酸产生的H2多 | |
| D. | 一定条件下反应2NO2(g)?N2O4(g)达到平衡时,v(NO2)逆=2v(N2O4)正 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的该溶液中含有0.2NA个SO42- | |
| B. | 该溶液中Cu2+、H+、NO3-可以大量共存 | |
| C. | 滴入Ba(OH)2溶液恰好使SO42-完全沉淀的离子方程式为:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| D. | 该溶液加热蒸干后得到Al2O3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)>c(SO42-)>c(NH4+) | |
| B. | c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | c(H+)=c(NH4+)+c(NH3•H2O)+c(OH-) | |
| D. | 室温下滴加NaOH溶液至溶液呈中性后:c(Na+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在温度不变时,水溶液中c(H+)和c(0H-)不能同时增大 | |
| B. | pH=3的盐酸和pH=5的硫酸等体积混合,pH=4 | |
| C. | 中性溶液中必然有c(H+)=c(0H-)=1×10-7mol/L | |
| D. | 在0.1mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3常用于制造红色油漆和涂料 | B. | 水玻璃可用作木材的防火剂 | ||
| C. | 铝制容器可用于盛装稀硫酸 | D. | 碘化银可用于人工降雨 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com