
A的阳离子、B的阴离子具有相同的电子层结构.A元素的单质与水反应生成B元素的单质.则:
(1)A为________,B为________.根据元素周期律,A的金属性比________弱,比________强(跟与A相邻的元素比较).
(2)A单质与水反应的化学方程式为________.
(3)A的阳离子、B的阴离子半径比较:_________>________.
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:043
本题是有关晶体的一组推断题,试填空:
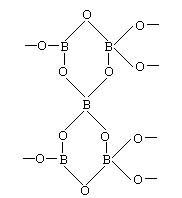
(1)(4分)有一种多聚硼酸盐为无限网状结构(如图),其结构的基本单元可表示为(B5On)m-,则m=________,n=________。
(2)(4分)根据离子晶体的晶胞(晶体中最小单位),求阴、阳离子个数的方法是:
①处于顶点的离子,即图中“![]() ”,同时为8个晶胞共用,每个离子有1/8属于此晶胞。
”,同时为8个晶胞共用,每个离子有1/8属于此晶胞。
②处于棱上的离子,即图中“![]() ”,同时为4个晶胞共用,每个离子有1/4属于此晶胞。
”,同时为4个晶胞共用,每个离子有1/4属于此晶胞。
③处于面心上的离子,即图中“▲”,同时为2个晶胞共用,每个离子有1/2属于此晶胞。
④处于体心上的离子,即图中“※”,为晶胞独享、全部属于此晶胞。

据此信息,解答下列问题:
现有甲、乙、丙(如图三种晶体的晶胞:(甲中x处于晶胞中心,乙中a处于晶胞中心)

可推知甲晶体中x与y的个数比是_________,乙晶体中a与b的个数比是________,丙晶体一个晶胞中有________个c离子,有________个d离子。
(3)(2分)1987年2月,朱经武教授等发现钇钡铜氧化合物在温度90K下即具有超导性,若该化合物的结构基本单元如图所示,则该化合物的化学式可能是( )
A.YBa2CuO7-x。 B.YBa2Cu2O7-x C.YBa2Cu3O7-x。 D.Yba2Cu4O7-x

(4)(4分)观察干冰晶体结构示意图(这仅是基本结构单元——晶胞),找出每个CO2周围离其最近且等距离的CO2分子的个数为________个,每个晶胞中真正拥有的CO2分子个数为________个。

查看答案和解析>>
科目:高中化学 来源:三点一测丛书 高中化学 必修2 (江苏版课标本) 江苏版课标本 题型:013
|
下列晶体中,含有阳离子而不含阴离的子是 | |
| [ ] | |
A. |
分子晶体 |
B. |
原子晶体 |
C. |
离子晶体 |
D. |
金属晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下图回答问题:
(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离
子位于8个顶点,该化合物中阳、阴离子的个数比是_______________。

(2)B图表示构成NaCl晶体的一个晶胞,通过想像与推理,可确定一个NaCl晶胞中含Na+
和Cl-的个数分别为_______________、_______________。
(3)C图是金刚石的晶体结构,C60、金刚石和石墨三者的关系是_______________。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是_______________NA个。二氧化硅的结构相当于在硅晶体结构中每个硅—硅单键之间插入一个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上原子数目是_______________。
(4)石墨晶体结构如D图所示,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数为_______________,“C—C”键数为_______________。
(5)足球烯C60结构形如足球,如E图,则C60中有_______________个六边形,_______________个五边形。固态时,C60属于_______________ (填“离子”、“原子”或“分子”)晶体,C60分子中含有双键的数目是_______________。
(6)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,如F图。其中含有
20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察F图,推断这个基本结构单元所含硼原子个数、键角、“B—B”键的个数依次为______________、_______________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:2011届四川省成都市石室中学高三“三诊”模拟考试(理综)化学部分 题型:单选题
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离予相差一个电子层,且可形成离子个数比为2:1的离子化合物丙。下列说法正确( )
A.B的最高价氧化物对应水化物化学性质稳定
B.C、D、E、F原子半径由大到小的顺序为C>D>E>F
C.B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
D.元素D、E、F的单质晶体属于同种类型的晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com