
| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 硫酸氢铵溶液中加入少量氢氧化钠溶液:NH4++OH-=NH3↑+H2O | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4 NH4++2H2O | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O |
分析 A.反应生成硝酸亚铁;
B.少量NaOH,只发生氢离子与碱的反应;
C.反应生成氢氧化铝和氯化铵;
D.发生氧化还原反应,遵循电子、电荷守恒.
解答 解:稀硝酸和过量的铁屑生成二价的铁,离子反应为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故A错误;
B.硫酸氢铵溶液中加入少量氢氧化钠溶液的离子反应为H++OH-=H2O,故B错误;
C.氢氧化铝不溶于氨水,氯化铝溶液中加入过量氨水的离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.Na2SO3溶液使酸性KMnO4溶液氧化而褪色,则该氧化还原反应的离子反应为5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应、复分解反应的离子反应考查,题目难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸使亚氯酸的氧化性增强 | |
| B. | 溶液中的H+起催化作用 | |
| C. | 溶液中的Cl-起催化作用 | |
| D. | 逸出的ClO2使反应生成物的浓度降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液中通入少量SO2:2CO32-+SO2+H2O=2HCO3-+SO32- | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═Fe2++I2 | |
| C. | 少量氯气通入溴化亚铁溶液中3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 | |
| D. | NaHCO3溶液水解:HCO3-+H2O=H2CO3+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 水、氨气 | ||
| C. | 氢氧化钠溶液、一氧化碳 | D. | 水、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 R、X、Y、Z是位于前四周期的元素,基态R原子核外电子占据3个能级,且每个能级上电子数相等,Y、X能组成两种阳、阴离子个数比为1:1、2:1型化合物.ZX2是常见的催化剂、氧化剂和电极材料,R、X、Y组成一种常见化合物,其水溶液常用于餐具的洗涤剂.R、X、Y原子的质子数之和等于Z的质子数.
R、X、Y、Z是位于前四周期的元素,基态R原子核外电子占据3个能级,且每个能级上电子数相等,Y、X能组成两种阳、阴离子个数比为1:1、2:1型化合物.ZX2是常见的催化剂、氧化剂和电极材料,R、X、Y组成一种常见化合物,其水溶液常用于餐具的洗涤剂.R、X、Y原子的质子数之和等于Z的质子数.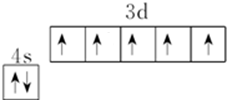 ;上述四种元素中,第一电离能最小的元素的基态原子核外有11种不同的电子运动状态.
;上述四种元素中,第一电离能最小的元素的基态原子核外有11种不同的电子运动状态.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com