
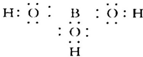 ,可知B原子最外层未达8个电子稳定结构,B原子具有空轨道,能结合含有孤电子对的原子形成配位键,能与H2O电离出的OH-结合形成配位键,据此分析解答.
,可知B原子最外层未达8个电子稳定结构,B原子具有空轨道,能结合含有孤电子对的原子形成配位键,能与H2O电离出的OH-结合形成配位键,据此分析解答.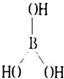 ,
, ;
;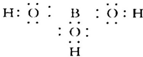 ,可知B原子最外层未达8个电子稳定结构,B原子具有空轨道,能结合含有孤电子对的原子形成配位键,所以能与H2O电离出的OH-结合形成配位键,从而破坏了水的电离平衡,使c(H+)>c(OH-)因而溶液呈酸性,电离方程式为
,可知B原子最外层未达8个电子稳定结构,B原子具有空轨道,能结合含有孤电子对的原子形成配位键,所以能与H2O电离出的OH-结合形成配位键,从而破坏了水的电离平衡,使c(H+)>c(OH-)因而溶液呈酸性,电离方程式为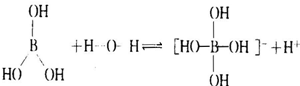 ,
,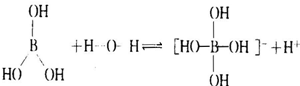 .
.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
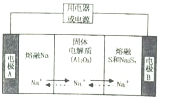 金属及其化合物在国民经济发展中起着重要作用
金属及其化合物在国民经济发展中起着重要作用| 物质 | Na | s | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、含Na+数目为
| ||
B、含氧原子数目为
| ||
C、完全氧化SO32-时转移电子数目为
| ||
D、含结晶水分子数目为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据物质的组成元素是否单一,将纯净物分为单质和化合物 |
| B、根据电解质溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
| C、根据分散系是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D、根据反应中的能量变化,将化学反应分为氧化还原反应、非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | ||
| B、向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | ||
C、Ba(OH)2溶液加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO
| ||
| D、向Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2OH-+Ca2+═MgCO3↓+CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R一定是共价化合物 |
| B、R一定是离子化合物 |
| C、R可能是共价化合物,也可能是离子化合物 |
| D、R可能是气态物质,也可能是固态物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
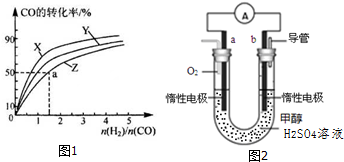
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com