
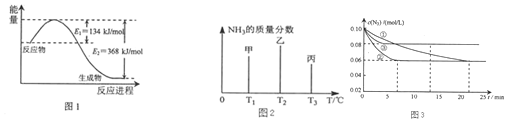
分析 (1)根据能量变化图,反应热=正反应的活化能-逆反应的活化能,结合热化学方程式的书写规则书写;
(2)依据氨气的质量分数变化可知,随温度升高,化学平衡应逆向进行,氨气的质量分数减小,丙氨气质量分数最小,所以丙一定是平衡状态,达到平衡状态,温度越高平衡逆向进行程度越大,氨气质量分数越小;
Ⅰ、实验②平衡时H2的转化率为α(H2)=$\frac{氢气浓度的变化量}{氢气浓度的起始量}×100%$.
Ⅱ、②到达平衡的时间比①短平衡时N2的浓度与①相同,化学平衡不移动;
Ⅲ、由平衡时氮气的浓度,通过三段式计算平衡时氮气氢气氨气的浓度,由平衡常数概念计算.
(3)铜与硝酸发生氧化还原反应,铜失去电子给硝酸中的氮元素,氧化还原反应得失电子总数相等,即铜失去的电子数=氮得到的电子数,可得答案.
解答 解:(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为CO(g)+NO2(g)=CO2(g)+NO(g)△H=-234 KJ/mol,
故答案为:CO(g)+NO2(g)=CO2(g)+NO(g)△H=-234 KJ/mol
(2)该反应是从正反应方向开始的,所以随着反应的进行,氨气的浓度逐渐增大,其含量也在不断升高,当反应达到平衡时达到最大值.此后,随着反应温度的升高,化学平衡逆向移动,氨气的浓度逐渐降低,其含量也在不断减少.由于T3比T2时少,说明T3的状态丙是已经达到平衡状态的.若三者都达到平衡状态.由于温度T1<T2<T3.升高温度,化学平衡向逆反应方向移动,氨气的质量分数降低.温度越高,逆向进行的程度越大,氨气质量分数越低,所以在都达到平衡状态时,氨气的质量分数最高的是甲.
Ⅰ、因为浓度变化量之比等于化学计量数之比,所以△c(H2)=3△c(N2)=3×(0.1-0.06 )mol/L=0.12mol/L,实验②平衡时H2的转化率为α(H2)=$\frac{氢气浓度的变化量}{氢气浓度的起始量}×100%$=$\frac{0.12}{0.26}×100%$=46.15%.
Ⅱ、根据图示的信息可知:②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动,故②与①相比加了催化剂.
Ⅲ、根据三段式计算得到平衡时各物质的浓度
N2(g)+3H2(g)=2NH3(g)
起始浓度:0.1 0.26 0
转化浓度:0.1-0.08=0.02 0.02×3=0.06 0.02×2=0.04
平衡浓度:0.08 0.26-0.06=0.2 0.04
平衡常数K=$\frac{0.04^2}{0.08×0.2^3}$L2•mol-2=2.5L2•mol-2
故答案为:丙; 甲;46.15%;加入催化剂;2.5L2•mol-2;
(3)参与反应的n(铜)=$\frac{3.2g}{64g/mol}$=0.5mol,设生成的NO的物质的量为x,则NO2的物质的量也为x,氧化还原反应中得失电子总数相等,铜失去的电子总数=氮得到的电子总数,则有0.05mol×2=3x+x,x=0.025mol,NO的体积为0.025mol×22.4L/mol=0.56L,
故答案为:0.56.
点评 本题考查了热化学方程式的书写,化学平衡和氧化还原反应的规律,其中化学平的综合考查难度稍大.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:解答题
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度g/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 节日期间,在任意场所燃放烟花爆竹 | |
| B. | 实验时,将水倒入浓硫酸配置稀硫酸 | |
| C. | 煤矿矿井,必须通风,严禁烟火 | |
| D. | 用点燃的火柴在液化气钢瓶口检验是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯与丙烯的混合气体中含有双键数目为NA | |
| B. | 标准状况下,22.4L甘油中含有羟基的数目为3NA | |
| C. | 1L0.1mol•L-1NaHS溶液中,HS-与S2-数目之和为0.1 NA | |
| D. | 0.2molCl2与0.1molCH4充分反应,生成HCl分子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱 | |
| B. | 一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞 | |
| C. | 在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| D. | 在河水与海水交界处有三角洲形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢原子的结构示意图为: ;则反氢原子的结构示意图为: ;则反氢原子的结构示意图为: | |
| B. | 反氢原子中有一个带负电荷的反质子和一个带正电荷的反电子 | |
| C. | 反氢原子的摩尔质量为1g/mol | |
| D. | 21H的反氢原子中有2个带负电荷的反质子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com