
【题目】在恒温恒容容器中发生N2O4(g)2NO2(g),若反应物的浓度由0.1molL﹣1降到0.06molL﹣1需20s,那么由0.06molL﹣1降到0.036molL﹣1,所需反应时间为( )
A. 10 sB. 12 sC. 大于12 sD. 小于12 s
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示是工业生产硝酸铵的流程。
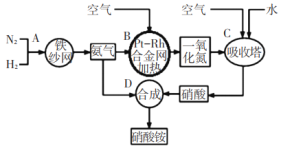
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:_____。
(2)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为![]() ,此时H2的转化率为_____。
,此时H2的转化率为_____。
(3)设备B中反应的化学方程式为____。
(4)利用以上流程,若N2与H2合成氨时,H2的转化率如上题所求,氨气催化氧化制硝酸时损失20%,其他环节损失忽略不计,则9吨H2最多可制取_____吨硝酸铵。
(5)某课外小组运用原电池原理合成氨,其装置结构如图所示:
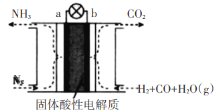
该装置的负极为_____(填a或b),试写出a极的电极反应式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼钼的化学原理为:
①2MoS2+7O2![]() 2MoO3+4SO2
2MoO3+4SO2
②MoO3+2NH3·H2O=(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl
④H2MoO4![]() MoO3+H2O
MoO3+H2O
⑤用还原剂将MoO3还原成金属钼。则下列说法中正确的是
A.MoS2煅烧产生的尾气可以直接排到空气中
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素a、b、c、d、e,其原子半径与原子序数的关系如图,下列说法错误的是
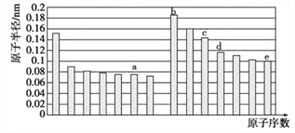
A. c元素的离子半径比e的离子半径小
B. d元素对应的最高价氧化物的水化物酸性比e元素弱
C. b、c、d三种元素对应的最高价氧化物的水化物相互间能发生反应
D. a与b两种元素可形成既有离子键又有非极性共价键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。某小组利用乙醛液相硝酸氧化法制备乙二醛并测定乙二醛纯度,装置如图所示:
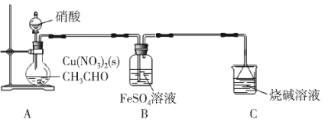
已知:①NO+FeSO4=FeSO4·NO(棕色)。
②几种有机物的部分性质如表所示:
乙醛 | 乙二醛 | 乙二酸 | 乙酸 | |
沸点/℃ | 20.8 | 50.5 | 109 | 117.9 |
溶解性 | 与水、有机溶剂互溶 | 溶于水、乙醇等 | 溶于水和有机溶剂 | 与水、乙醇互溶 |
密度/gcm-3 | 0.78 | 1.27 | 1.90 | 1.05 |
相对分子质量 | 44 | 58 | 90 | 60 |
实验步骤:
①取20 mL乙醛装于烧瓶,加入2 g Cu(NO3)2粉末作催化剂,向烧瓶中缓慢滴加2 mol·L-1硝酸至乙醛完全反应为止;
②提纯产品,最终得到10.0 mL产品。
请回答下列问题:
(1)盛装硝酸的仪器名称是___________。
(2)实验中,观察到装置B中溶液变为棕色,制备乙二醛的化学方程式为________________。
(3)向烧瓶中滴加硝酸要“缓慢”,其目的是___________;判断烧瓶中制备乙二醛的反应已完成的标志是___________。
(4)分离提纯产品,宜选择下列装置___________(填字母)。
(5)根据上述实验数据,该实验中乙二醛的产率约为___________(填字母)。
a.56.5% b.61.8% c.67.9% d.72.6%
(6)实验室可用酸性KMnO4溶液测定乙二醛的纯度,发生反应的离子方程式为:18H++6MnO4-+5C2H2O2→10CO2↑+6Mn2++14H2O。实验步骤如下:取V mL产品,加蒸馏水稀释至250 mL,量取25.00 mL稀释后的溶液于锥形瓶,滴加5.00 mL稀硫酸,用c mol·L-1 KMnO4溶液,三次平行实验消耗KMnO4溶液体积如下:
实验 | Ⅰ | Ⅱ | Ⅲ |
V[KmnO4(aq)]/mL | 20.05 | 22.40 | 19.95 |
滴定终点的标志是___________;该产品纯度为___________g·mL-1(用含V和c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿“烧渣”(主要成分Fe3O4,Fe2O3,FeO和部分难溶于酸的杂质)制备绿矾(FeSO47H2O)的流程如下:

已知:FeS2(S的化合价为-1)难溶于水。
(1)①中加入的酸为____________(填名称)。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、____________。
(3)检验②中Fe3+已经完全转化为Fe2+实验方法:取适量溶液2,____________。
(4)通过③得到绿矾晶体的实验操作:加热浓缩、冷却结晶、____________、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到目的是
A.用萃取的方法分离煤油和汽油
B.用水鉴别苯、四氯化碳、乙醇三种无色液体
C.用如图装置验证Na和水反应是否为放热反应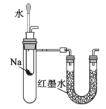
D.棉织品与丝织品可以用灼烧法进行鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:

(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、②的化学方程式是___________________、__________________。
(2)基态铜原子的核外电子排布式为________,硫、氧元素相比,第一电离能较大的是________。
(3)反应①和②生成的气体分子的中心原子的杂化类型是________,分子的空间构型是________。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到相应目的的是
A | B | C | D | |
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com