
(1)已知:① TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
②2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:________________。
(2)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是:
A.CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
B.CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-676.7 kJ·mol-1
由上述方程式可知,CH3OH的标准燃烧热________(填“大于”“等于”“小于”或“不能确定”)-676.7 kJ·mol-1。已知水的气化热为44 kJ·mol-1,则氢气燃烧的热化学方程式为__________________________。
(1)TiO2(s)+2C(s)+2Cl2(g)=TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1
(2)不能确定 H2(g)+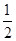 O2(g)=H2O(l) ΔH=-285.9
kJ·mol-1
O2(g)=H2O(l) ΔH=-285.9
kJ·mol-1
【解析】
试题分析:(1)将①+②可得:TiO2(s)+2C(s)+2Cl2(g)=TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1
(2)由于A产物是氢气,不是化合物,B产物是气态的水,不是稳定的化合物的状态。所以不能确定CH3OH的标准燃烧热。将(A─B)÷3可得:H2(g)+1/2O2(g)=H2O(g)
ΔH= -241.9KJ/mol.由于水的气化热为44 kJ·mol-1,所以氢气燃烧的热化学方程式为:H2(g)+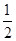 O2(g)=H2O(l) ΔH=-285.9
kJ·mol-1
O2(g)=H2O(l) ΔH=-285.9
kJ·mol-1
考点:考查盖斯定律及应用。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 737 | 1451 | 7733 | 10540 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z三种元素,原子序数依次减小.X是第四周期主族元素,其部分电离能如图1所示;X、Y元素具有相同的最高正化合价;Z元素是形成化合物种类最多的元素.回答下列问题:
X、Y、Z三种元素,原子序数依次减小.X是第四周期主族元素,其部分电离能如图1所示;X、Y元素具有相同的最高正化合价;Z元素是形成化合物种类最多的元素.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定 序号 |
待测液体积/mL | NH4Fe(SO4)2标准溶液 滴定管起点读数/mL |
NH4Fe(SO4)2标准溶液 滴定管终点读数/mL |
| 1 | 25.00 | 0.02 | 24.02 |
| 2 | 25.00 | 0.08 | 24.06 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年辽宁省沈阳二中高二下学期期中考试化学试卷(带解析) 题型:填空题
(6分)钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C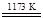 TiCl4+2CO ②TiCl4+2Mg
TiCl4+2CO ②TiCl4+2Mg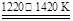 Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
① TiCl4为______晶体(填“离子”、“原子”或“分子”)。
② TiCl4分子为正四面体形,则Ti为________杂化。
③ TiCl4在潮湿空气中水解的化学方程式是_________________________________。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com