
分析 当达到平衡状态时,测得容器中SO2(g)的转化率为50%,则转化的SO2为2mol×50%=1mol,则
SO2(g)+NO2(g)?SO3(g)+NO(g)
开始 2 2 0 0
转化 1 1 1 1
平衡 1 1 1 1
K=$\frac{\frac{1mol}{10L}×\frac{1mol}{10L}}{\frac{1mol}{10L}×\frac{1mol}{10L}}$=1,温度不变,K不变,
若该温度下向该容器中再继续加入1mol的SO2(g),平衡正向移动,则
SO2(g)+NO2(g)?SO3(g)+NO(g)
开始 2 1 1 1
转化 x x x x
新平衡 2-x 1-x 1+x 1+x
$\frac{(1+x)(1+x)}{(2-x)(1-x)}$=1,解得x=0.2mol,
结合c=$\frac{n}{V}$、转化率=$\frac{转化的量}{开始的量}$×100%计算.
解答 解:当达到平衡状态时,测得容器中SO2(g)的转化率为50%,则转化的SO2为2mol×50%=1mol,则
SO2(g)+NO2(g)?SO3(g)+NO(g)
开始 2 2 0 0
转化 1 1 1 1
平衡 1 1 1 1
K=$\frac{\frac{1mol}{10L}×\frac{1mol}{10L}}{\frac{1mol}{10L}×\frac{1mol}{10L}}$=1,温度不变,K不变,
若该温度下向该容器中再继续加入1mol的SO2(g),平衡正向移动,则
SO2(g)+NO2(g)?SO3(g)+NO(g)
开始 2 1 1 1
转化 x x x x
新平衡 2-x 1-x 1+x 1+x
$\frac{(1+x)(1+x)}{(2-x)(1-x)}$=1,解得x=0.2mol,
①由上述分析可知,化学平衡向正反应方向移动,故答案为:向正反应方向;
②当达到新的平衡状态时,容器中SO2(g)的浓度是$\frac{2mol-0.2mol}{10L}$=0.18mol/L,故答案为:0.18;
③最后SO2的转化率为$\frac{1mol+0.2mol}{2mol+1mol}$×100%=40%;NO2的转化率变为$\frac{1mol+0.2mol}{2mol}$×100%=60%,故答案为:40;60.
点评 本题考查化学平衡,为高频考点,把握化学平衡三段法、浓度及转化率的计算为解答的关键,侧重分析与应用能力的考查,注意平衡移动方向及温度不变时K不变,题目难度不大.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 纤维素、蛋白质 | B. | 蛋白质、塑料 | C. | 蛋白质、多糖 | D. | 油脂、蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属晶体导电是物理变化,离子晶体在熔融态时导电是化学变化 | |
| B. | H2O分子很稳定是因为H2O分子间存在氢键 | |
| C. | ①硫酸比次氯酸稳定;②S2-易被氯气氧化,均能说明氯元素的非金属性比硫元素强 | |
| D. | P4和CH4都是正四面体分子且键角都为109.28ˊ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由溴丙烷水解制丙醇,由丙烯与水反应制丙醇 | |
| B. | 由甲苯硝化制对硝基甲苯,由甲苯氧化制苯甲酸 | |
| C. | 由乙醛制乙醇,由乙醛制乙酸 | |
| D. | 由乙酸和乙醇制乙酸乙酯,由苯甲酸乙酯水解制苯甲酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-(配离子)物质的量浓度的对数.
如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-(配离子)物质的量浓度的对数.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 起始浓度 | 平衡浓度 | |
| c(H2)/mol•L-1 | c(I2)/mol•L-1 | c(HI)/mol•L-1 | |
| 甲 | 0.01 | 0.01 | 0.004 |
| 乙 | 0.01 | 0.02 | a |
| 丙 | 0.02 | 0.02 | b |
| A. | 平衡时,H2的转化率:甲<丙 | B. | HI的平衡浓度:a>0.004;b=0.008 | ||
| C. | 平衡时,乙中H2的转化率等于20% | D. | 丙反应的平衡常数K=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用海洋能发电是一种传统能源 | |
| B. | “水能摩擦纳米发电机”是一种原电池 | |
| C. | 发展“水能摩擦纳米发电机”符合“低碳经济”的要求 | |
| D. | “水能摩擦纳米发电机”是将动能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KI+Br2═2KBr+I2 | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | NaH+H2O═NaOH+H2↑ | D. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 元素的相关信息 |
| A | A元素存在多种同素异形体,其中一种常用电极导电材料 |
| B | 短同期中金属性最强 |
| C | 单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
| E | 地壳中含量最多的金属 |
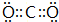 ,含有的化学键类型为共价键;
,含有的化学键类型为共价键;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com