
����Ŀ�������С³����ͷ�����ý�ͷ���棬���ŷ�������������ټӴ���������ԣ�Ȼ���������к��Ϲ������ɡ�С³�������ϵ�֪����ͷ��ʹ���������������²���CO2���壬�Ӷ�ʹ�������ɣ���ͬʱҲ��������ᡢ������л��ᡣ
��1�����й��ڴ������ʶ��ȷ����___��
A�������ֽ� B��ˮ��Һ�Լ��� C�����ڼ� D�������ᷴӦ
��2��С³̽����Na2CO3����������ȣ�������NaHCO3��ԭ��
��Na2CO3��NaHCO3������Ϊ1gʱ������H+�����ʵ����������___��
����Na2CO3��NaHCO3Ϊ������������H+�����ʵ�����д��������̡�___
��3��С³ʵ�ʲ���ʱ���������ŷ��ò��ã������ڵ������٣�������ζ������ָ��С³��Na2CO3����NaHCO3���������棬�Ϲ������Ȼ��������������ͷ������NaHCO3������___��
��4��ijƷ�Ƹ������ɼ���˵������ͼ��ʾ��

������������-��-�����͵������������������Ƿ�ֹ���ɼ���������ʧЧ�������������Ƶ�������___��
���𰸡�BD Na2CO3 Na2CO3��1/53(0.0189)��NaHCO3��1/84(0.0119) ���ȷֽ����CO2���壬�Ӷ�ʹ�������ɣ������ᡢ������л��ᷴӦ��������ζ �ṩH+��NaHCO3��CaCO3��Ӧ����CO2���壬�Ӷ�ʹ��������
��������
��1������Ϊ̼���ƣ�����ǿ�������Σ�ˮ��Һ�Լ��ԣ������ᷴӦ���ɶ�����̼��ˮ��
��2����Na2CO3��NaHCO3����H+�����ʵ���֮��Ϊ![]() ��
��![]() =84��53��
=84��53��
��Na2CO3��NaHCO3����H+�����ʵ����ֱ�Ϊ![]() =0.0189mol��
=0.0189mol��![]() =0.0119mol��
=0.0119mol��
��3��NaHCO3�����ᡢ������л��ᷴӦ��������ζ�������ȷֽ����CO2���壬�Ӷ�ʹ�������ɣ�
��4�����������������ṩH+��NaHCO3��CaCO3��Ӧ����CO2���壬�Ӷ�ʹ�������ɡ�
��1������Ϊ̼���ƣ�����ǿ�������Σ�ˮ��Һ�Լ��ԣ������ᷴӦ���ɶ�����̼��ˮ������������ΪBD��
��2����Na2CO3��NaHCO3������Ϊ1gʱ������H+�����ʵ���֮��Ϊ![]() ��
��![]() =84��53��̼�������ĵ������Ӷࣻ
=84��53��̼�������ĵ������Ӷࣻ
��Na2CO3��NaHCO3����H+�����ʵ����ֱ�Ϊ![]() =0.0189mol��
=0.0189mol��![]() =0.0119mol��
=0.0119mol��
��3��NaHCO3�����ᡢ������л��ᷴӦ��������ζ�������ȷֽ����CO2���壬�Ӷ�ʹ�������ɣ�
��4�����������������ṩH+��NaHCO3��CaCO3��Ӧ����CO2���壬�Ӷ�ʹ�������ɡ�


 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijƷ������Ƭ��Ѫ������ȥ���º��Ե�����ɫ����Ҫ�ɷ������������������������Ļ����ij�о���ѧϰС��Ϊ�ⶨ�ò�Ѫ�������������ĺ�����������ͼ1̽����

��ش��������⣺
��ʵ��ʱ��10molL-1��Ũ��������100mL1molL-1H2SO4��Һ��
��1��������Ͳ��ȡ____mL����Ũ����������ơ�
��2�������ʵ�������У��ٽ�ͷ�ιܡ����ձ�������Ͳ���ܲ�����������ϡ����ʱ����ȱ�ٵIJ���������____�����������߱��Ĺ�����____������ţ���
A������һ�����ȷŨ�ȵ���Һ
B������������Һ
C��������������Ͳ��ȡһ�������Һ��
D�������ܽ��������
��3����ͼ2���ƹ���ʾ��ͼ�У�������У�����ţ�_____��
��4�����в������������Ƶ�ϡ��������ʵ���Ũ��ƫ�͵���______����ĸ����
A������Ͳ��ȡŨ����ʱ���Ӱ�Һ��
B����Ũ����ϡ�ͺ�δ��ȴ�����±㽫��Һת��������ƿ
C������ƿ������ˮϴ��δ����
D������ʱ����Һ��
E��δϴ���ձ��Ͳ�����
F��ת�Ƶ�����ƿ�Ĺ����У�����������Һ����
G������Ͳ��ȡŨ���ᵹ��С�ձ���������ˮϴ����Ͳ����ϴ��Һת����С�ձ���
H���ò��������Ͳ��ȡŨ����
��1��������в����ĺ��ɫ�����ǣ��ѧʽ��_____��
��2���Ӻ��ɫ������Һ���õ��������ij�����һϵ�й���������Ļ�������Ϊ��
a��____��b��ϴ�ӣ�c�����գ�d����ȴ��
��3�����Ƶù��������Ϊag����ÿƬ��Ѫ���к���������������Ϊ____ g��
��4��д������ڵ����ӷ���ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ��ƣ�NaCl���������г��õĻ�ѧƷ��Ҳ����Ҫ�Ļ�������ԭ�ϡ�
��ʵ�����о��Ȼ��Ƶ����ʼ��Ʊ�
��1���Ȼ��ƹ��岻���磬���Ȼ�����Һ�ܵ��磬�û�ѧ��������Ȼ�����Һ�ܵ����ԭ��___��
��2��ʵ���Ҽ���Cl�����Լ���___��
��3��ijͬѧ������Ԫ�صIJ�ͬ��������Ʊ�NaCl����ѧ��Ӧ����ʽ���£�
a��2Na+Cl2![]() 2NaCl
2NaCl
b��Na2O+2HCl=2NaCl+H2O
c��
d��Na2CO3+2HCl=2NaCl+CO2��+H2O
���벹��c��Ӧ�Ļ�ѧ����ʽ��___��
��Ҳ������������Һ���Ӧ����Ȼ��ƣ��÷�Ӧ�Ļ�ѧ����ʽΪ___��
��ҵ�������Ȼ��Ƶ��Ʊ�
�ҹ�ʳ�ε���Դ��ҪΪ���Ρ����Ρ������Ρ���ʳ���г��˺���ɳ�������������⣬������Ca2+��Mg2+��SO42���ȿ��������ʡ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽�����������£�
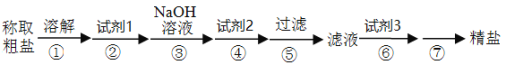
��4��д�����и��Լ��Ļ�ѧʽ
�Լ�1��___���Լ�2��___���Լ�3��___��
��5����������漰�������ӷ���ʽ�У�___��
��6��������漰�IJ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeO��Fe2O3�Ļ�������ɿˣ�������H2�����м��ȳ�ַ�Ӧ����ȴ��Ƶ�ʣ������ԭ��������0.8g������������ԭ����������ᷴӦ����ʹ֮��ȫ�ܽ�, ������Ҫ1molL��1����������Ϊ�� ��
A. 0.05 LB. 0.1 LC. 0.2 LD. 1 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������̵���Ҫ������ͳ��õ��������������ǹ�ҵ�������̿��Ʊ�������ص�һ�ֹ������̣�
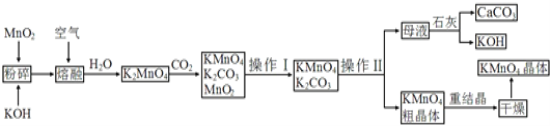
��1�� KMnO4ϡ��Һ��һ�ֳ��õ���������������ԭ��������_____�������ơ�
A��75%�ƾ��� B��˫��ˮ ������C������ D����84������Һ��NaClO��Һ��
��2���������������________���������Ǹ���KMnO4��K2CO3��������__________ �������ʣ��ϲ��죬���� __________����������裩�����ȹ��˵õ�KMnO4�־���ġ�
��3�����������п���ѭ��ʹ�õ�������ʯ�ҡ�CO2��____��____ ��д��ѧʽ����
��4�� ��K2MnO4��Һ��ͨ��CO2���Ʊ�KMnO4���÷�Ӧ�еĻ�ԭ����_______��
��5�� �����ƣ�NaBiO3��������ˮ�����ڶ��Լ���������Һ��Mn2+�Ĵ��ڣ���Ԫ�صĻ�ԭ����ΪBi3+��Mn����������Ϊ+7�ۣ���д����Ӧ�����ӷ���ʽ��__________________��
��6�� д��MnO2��KOH�����ڻ������ͨ�����ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽ��________________��
��7��������������ѭ�����Ʊ������е���ʧ����1mol MnO2���Ƶ�_____mol KMnO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£��������NH3��CH4�������壬�����й�˵���������
A.����������Ŀ��ͬB.������ԭ�����ʵ���֮��Ϊ3��4
C.����֮��Ϊ16��17D.�ܶ�֮��Ϊ17��16
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������ͽ��۾���ȷ���ǣ� ��
ѡ�� | ʵ����� | ���� | ���� |
A | ֲ���ͺ���ˮ��Ϻ������� | ��Һ�ֲ㣬��ˮ��ɫ | ֲ������ȡ����ˮ�е�Br2 |
B | �������ữ��H2O2����Fe��NO3��2��Һ�� | ��Һ���ɫ | H2O2�������Ա�Fe3+�� |
C |
| ���ְ�ɫ���� | ������������̼�뱥��ʳ��ˮ��ӳ����̼���� |
D | ��ʢ��ͭ��Ũ������Թܼ��ȣ������Թܵײ����ְ�ɫ���壬��ȥ�Թ���Һ�壬�ټ�������ˮ | ��ɫ�����ܽ⣬��Һ����ɫ | ��ɫ����Ϊ��ˮ����ͭ |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����º����£���2molA�����2molB����ͨ�����Ϊ2L���ܱ������з������·�Ӧ��2A(g)+B(g)![]() xC(g)+2D(s)��2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2molB�������C��Ũ��Ϊ1.2mo1��L��1��
xC(g)+2D(s)��2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2molB�������C��Ũ��Ϊ1.2mo1��L��1��
(1)�ӿ�ʼ��Ӧ���ﵽƽ��״̬������C��ƽ����Ӧ����Ϊ____________________��
(2)x =________��
(3)A��ת������B��ת����֮��Ϊ___________��
(4)���и������Ϊ�÷�Ӧ�ﵽƽ��״̬�ı�־����_________��
A��ѹǿ���ٱ仯
B�������ܶȲ��ٱ仯
C������ƽ����Է����������ٱ仯
D��A������������B����������֮��Ϊ2��1
(5)��ʹ��Ӧ�ﵽƽ��ʱ��C�����ʵ�������������ƽ����ȣ���ʼ����A��B�����ʵ���n(A)��n(B)֮��Ӧ����Ĺ�ϵΪ ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Ĺ�ҵ��ˮ�к��д�����FeSO4���϶��CuSO4������Na2SO4��Ϊ�˼�����Ⱦ�����Ϊ���������ƻ��Ӹ÷�ˮ�л������������ͽ���ͭ���������������ͼ����ɻ�������������ͭ��ʵ�鷽�������ɹ�ѡ����Լ�Ϊ���ۡ�ϡH2SO4��NaOH��Һ���Լ���
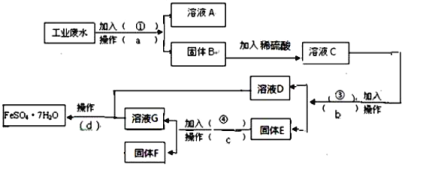
��1������a������Ϊ___������Ҫ�IJ����������ձ����Ҫ___��
��2������E�ijɷ�Ϊ___�������Լ���ʱ�����Ļ�ѧ����ʽΪ___��
��3�������Լ��ٵ�Ŀ����___��
��4������ҺD����ҺG�еõ�FeSO4��7H2O����IJ���Ϊ����Ũ����___��___��ϴ�ӡ����
��5������ˮ����������������ͭ����������ɵĻ����Һ������c(Cu2��)��0.1mol/L��c(Fe2��)��0.4mol/L��c(SO42-)��0.6 mol/L����֪������Ũ�Ⱥ��Բ��ƣ���c(Na��)Ϊ___��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com