
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Mg2+、Al3+、NO3-、Cl- | |
| B. | 使pH试纸显蓝色的溶液中:NH4+、NO3-、SO42-、Na+ | |
| C. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Mg2+、K+、Cl-、NO3- | |
| D. | pH=0的溶液中:K+、Fe3+、SO42-、SCN- |
分析 A.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液,显酸性;
B.使pH试纸显蓝色的溶液,显碱性;
C.由水电离的c(H+)=1×10-14mol•L-1的溶液,为酸或碱溶液;
D.pH=0的溶液,显酸性,离子之间结合生成络离子.
解答 解:A.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液,显酸性,该组离子之间不反应,可大量共存,故A正确;
B.使pH试纸显蓝色的溶液,显碱性,不能大量存在NH4+,故B错误;
C.由水电离的c(H+)=1×10-14mol•L-1的溶液,为酸或碱溶液,碱溶液中不能大量存在Mg2+,故C错误;
D.pH=0的溶液,显酸性,Fe3+、SCN-结合生成络离子,不能共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重复分解反应、络合反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
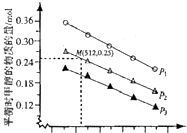
| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ•mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | 物质A的转化率变大 | ||
| C. | 物质B的质量分数增加 | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按熔点由低到高排列I2、CO2、Hg、KCl、SiO2 | |
| B. | 在石英晶体中,每个硅原子和相邻的两个氧原子以共价键结合 | |
| C. | 有机物分子中碳原子成键方式和排列方式有多种以及同分异构现象的存在都是有机物种类繁多的原因 | |
| D. | 因为石墨是金刚石的同素异形体,所以二者空间结构相似,化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:Na+、K+、MnO4-、NO3- | |
| B. | pH=13的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 0.1 mol•L-1 NaClO溶液中:K+、Na+、NO3-、I- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Na+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
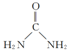 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com