
| A. | 将CO2通人CaCl2溶液中 | B. | 将H2S气通人到浓硫酸中 | ||
| C. | 将SO2通人Ba(0H)2溶液中. | D. | 氢硫酸长期露置在空气 |
分析 A.氯化钙与二氧化碳不反应;
B.浓硫酸具有强氧化性,能够氧化硫化氢;
C.二氧化硫能够与氢氧化钡溶液反应生成亚硫酸钡沉淀;
D.硫化氢能够被空气中氧气氧化成S单质.
解答 解:A.将CO2通人CaCl2溶液中,二者不会反应,则不会出现沉淀现象,故A正确;
B.硫化氢具有还原性,能够被浓硫酸氧化,所以将H2S气通人到浓硫酸中会生成S单质,出现沉淀现象,故B错误;
C.将SO2通人Ba(0H)2溶液中,当二氧化硫少量时生成亚硫酸钡,故C错误;
D.硫化氢在空气中易被氧气氧化生成S单质,会出现沉淀现象,故D;
故选A.
点评 本题考查了常见物质的性质及综合应用,题目难度不大,明确常见物质的性质及离子反应发生条件为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 硝酸钾制备实验中,将NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可以分离出硝酸钾 | |
| B. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 | |
| C. | 减压过滤操作时,应将滤纸放入布氏漏斗内,滤纸大小应略大于漏斗内径才能将全部小孔盖住 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L的密闭容器中,X、Y、Z三种物质(其中X为固体,Y、Z为气体)的物质的量随时间的变化曲线如图所示:
某温度时,在2L的密闭容器中,X、Y、Z三种物质(其中X为固体,Y、Z为气体)的物质的量随时间的变化曲线如图所示:| 改变条件 | 降低温度 | 增加X的量 | 使用催化剂 | 容器体积减半 |
| 速率变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示电解装置的电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.通电时发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.
如图所示电解装置的电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.通电时发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
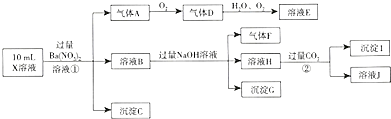
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com