
(11分)实验室里,用MnO2与浓盐酸反应来制取适量的氯气。现用100mL的浓盐酸与MnO2反应,生成的氯气在标准状况时的体积为5.6L,请计算:
(1)用“双线桥法”标出电子转移情况
MnO2
+ 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
(2)理论上需要参加反应的二氧化锰多少克?
(3)被氧化的HCl的质量为多少克?
(11分)
(1)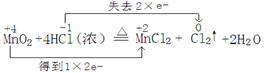 (3分)
(3分)
(2)(4分)21.75g (3)(4分)18.25g
【解析】(1)在反应中,锰元素的化合价是+4价,生成物中是+2价,所以二氧化锰是氧化剂,转移2个电子。氯化氢中氯元素的化合价从-1价升高到0价,氯化氢是还原剂,所以方程式为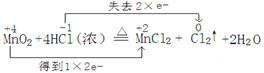
(2)生成的氯气在标准状况时的体积为5.6L,其物质的量是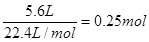 ,根据方程式可知
,根据方程式可知
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
87g 1mol
m 0.25mol
所以m=87g×0.25mol÷1mol=21.75g。
(3)根据氯原子守恒可知,被氧化的氯化氢是0.25mol×2×36.5g/mol=18.25g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省焦作市高一第一学期期末考试化学试卷(带解析) 题型:计算题
(11分)实验室里,用MnO2与浓盐酸反应来制取适量的氯气。现用100mL的浓盐酸与MnO2反应,生成的氯气在标准状况时的体积为5.6L,请计算:
(1)用“双线桥法”标出电子转移情况
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
(2)理论上需要参加反应的二氧化锰多少克?
(3)被氧化的HCl的质量为多少克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com