
 (1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
(1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:| I1 | I2 | I3 | I4 | |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性 | 1.0 | 1.57 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.61 | 1.8 | 2.1 | 2.5 | 3.0 |
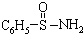 ,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)
,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)分析 (1)从其电离能变化知,当原子失去第四个电子时,其电离能急剧增加,说明该元素失去三个电子时为稳定结构,则该元素最外层有3个电子;
(2)题中给出的x值与其原子在分子中吸引电子的能力有关,可根据元素周期性变化来推测Mg的x值,以表中数值可看出,同周期中元素的x值随原子半径的减小而增大,同主族自上而下x值减小,x值的变化体现周期性的变化;当电负性之差大于1.7时,为离子键,小于1.7为共价键;
(3)①根据质量生成判断A的化学式,并以此确定晶体类型;
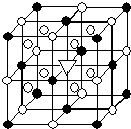
②该晶胞中●个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,○个数=12×$\frac{1}{4}$+8=11,根据化学式知,冰晶石中阳离子和阴离子个数之比为3:1,据此判断大立方体的体心处▽所代表的微粒;
③该晶胞的体积为a3cm3,质量为4×$\frac{M}{{N}_{A}}$,根据ρ=$\frac{m}{V}$计算.
解答 解:(1)从其电离能变化知,当原子失去第四个电子时,其电离能急剧增加,说明该元素失去三个电子时为稳定结构,则该元素最外层有3个电子,N原子最外层有5个电子、Al氧原子最外层有3个电子、Si原子最外层有4个电子、S原子最外层有6个电子、O原子最外层有6个电子,所以符合条件的是Al元素,
故答案为:铝;
(2)①依据Mg在元素周期表中的位置,同周期介于钠和铝之间其电负性范围:0.9<x<1.61,同主族应小于Be,既x<1.57,综上,0.9<x<1.57,
故答案为:0.9<x<1.57;
②电负性2.5<x(N)<3.5,大于S的2.5,则N原子电负性强,共用电子对偏向氮,故答案为:氮;
③元素电负性的差值一般大于1.7时,原子间形成离子键,小于该值则原子间形成共价键,Be和F的电负性之差为 4.0-1.57=2.43>1.7,为离子键,
Si和Cl的电负性之差为3.0-1.8=1.2<1.7,为共价键.
故答案为:1.7;离子键;共价键;
(3)①根据反应的方程式并依据原子守恒可知,A应该是Na2CO3.Na2CO3是离子化合物,属于离子晶体,故答案为:Na2CO3;离子;
②根据晶胞的结构可知,晶胞中含有●的个数是8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个,含有○的个数是12×$\frac{1}{4}$+8=11.根据化学式知,Na+和[AlF6]3- 的个数比是3:1,则白色球和黑色球之比接近3:1,要使其为3:1,则▽所代表的应该是Na+,
故答案为:Na+;
③该晶胞的体积为a3cm3,质量为4×$\frac{M}{{N}_{A}}$,根据ρ=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{{a}^{3}}$g/cm3=$\frac{4M}{{{N_A}×{a^3}}}$g/cm3,则NA=$\frac{4M}{ρ{a}^{3}}$/mol,
故答案为:$\frac{4M}{ρ{a}^{3}}$/mol.
点评 本题考查晶胞计算、电负性、电离能、原子核外电子排布等知识点,为高考高频点,知道电离能规律及反常现象、构造原理等知识点,熟练掌握物质结构知识,难点是晶胞计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
 大家都知道 6月1日 是国际儿童节,但或许绝大多数人并不了解这天同时也是“世界牛奶日”.20世纪50年代,法国的促进牛奶消费协会提出了庆祝“牛奶日”的设想,并做出了每年5月第三周的周二为“国际牛奶日”的决定,2000年经联合国粮农组织(FAO)的提议,兼顾到某些国家已经确定的日期,并征得了世界700多位乳业界人士的意见,把每年的 6月1日 确定为“世界牛奶日”.人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体〔Ca10(PO4)6(OH)2〕形式存在.牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品.如图是某乳业公司纯牛奶包装标签的部分文字.请仔细阅读后回答下列问题:
大家都知道 6月1日 是国际儿童节,但或许绝大多数人并不了解这天同时也是“世界牛奶日”.20世纪50年代,法国的促进牛奶消费协会提出了庆祝“牛奶日”的设想,并做出了每年5月第三周的周二为“国际牛奶日”的决定,2000年经联合国粮农组织(FAO)的提议,兼顾到某些国家已经确定的日期,并征得了世界700多位乳业界人士的意见,把每年的 6月1日 确定为“世界牛奶日”.人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体〔Ca10(PO4)6(OH)2〕形式存在.牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品.如图是某乳业公司纯牛奶包装标签的部分文字.请仔细阅读后回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
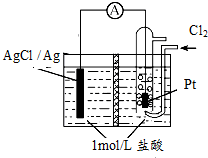 某原电池装置如图所示,中间是某种离子交换膜,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
某原电池装置如图所示,中间是某种离子交换膜,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )| A. | 电池放电时的负极反应为Ag-e-=Ag+ | |
| B. | 若使用阳离子交换膜,当电路中转移0.01 mol e-时,交换膜左侧溶液质量减少36.5g | |
| C. | 以Pt作电极,除了导电之外,还有催化剂的作用 | |
| D. | 用该电池给铅蓄电池充电,若有11.2L的Cl2参加电池反应,则理论上铅蓄电池的负极质量增加48g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
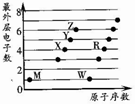 X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )
X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )| A. | X2M2、W2Z2均为直线型的共价化合物 | |
| B. | X能与RZ2反应生成R和XZ,证明X非金属性比R强 | |
| C. | X、Y、Z分别与M元素形成的简单化合物,其稳定性依次递减 | |
| D. | 1mol由W与M元素组成的化合物,常温下与水完全反应能生成2g气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| B. | 硅是半导体材料,可用于制备光导纤维 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中由水电离出的c(H+)=l×10-13mol/L | |
| B. | 0.1mol•L-1 HA溶液与0.05mol•L-1 NaOH溶液等体积混合后所得溶液中:c(H+)+c(Na+)=c(OH-)+c(A-) | |
| C. | 由pH=4的HA与pH=10的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH一)>c(H+) | |
| D. | 浓度均为0.1mol/L的HA和NaA溶液等体积混合,若溶液呈酸性,则:c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| 1 | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| 2 | Cl2、FeBr2 | FeCl3、FeBr3 |
| 3 | MnO4-、Cl-… | Cl2、Mn2+… |
| A. | 第1组反应的其余产物只有H2O | |
| B. | 第2组反应中Cl2与FeBr2的物质的量之比可能等于1:2 | |
| C. | 第3组反应中生成22.4L,一定转移电子2mol | |
| D. | 氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com