
下列说法正确的是()
A. 增大压强,活化分子数增加,化学反应速率一定增大
B. 升高温度,活化分子百分数增加,化学反应速率一定增大
C. 活化分子间所发生的分子间的碰撞为有效碰撞
D. 加入反应物,使活化分子百分数增加,化学反应速率增大
考点: 化学反应速率的影响因素.
专题: 化学反应速率专题.
分析: A、增大压强,使浓度增大,活化分子百分数增加;
B、升高温度,活化分子百分数增加,化学反应速率增大;
C、活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞;
D、加入反应物,活化分子百分数不变.
解答: 解:A、增大压强,使浓度增大,活化分子浓度增加,化学反应素速率增大,故A错误;
B、升高温度,活化分子百分数增加,化学反应速率一定能够增大,故B正确;
C、活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞,故C错误;
D、加入反应物,活化分子百分数不变,但活化分子总数增加,化学反应速率增大,故D错误.
故选B.
点评: 本题考查学生影响化学反应速率的因素中的温度、浓度因素,可以根据所学知识进行回答,难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
下列无色溶液中,各组离子能大量共存的是()
A. Ca2+、K+、Cl﹣、NO3﹣ B. Ag+、Na+、NO3﹣、Cl﹣
C. Cu2+、K+、SO42﹣、Cl﹣ D. Ba2+、NH4+、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物在材料领域中应用广泛.下列叙述中不正确的是( )
A. 硅单质可用来制造太阳能电池
B. 装碱性溶液的玻璃试剂瓶不能用玻璃塞
C. 二氧化硅是制造光导纤维的材料
D. 二氧化硅属于酸性氧化物,不能与任何酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,正确的是( )
A. 氧化亚铁和稀硝酸反应FeO+2H+═Fe2++H2O
B. 硫酸铝溶液与足量烧碱:Al3++3OH﹣=Al(OH)3↓
C. 氯化亚铁溶液中滴入氯水Cl2+2Fe2+═2Cl﹣+2Fe3+
D. 金属铝投入NaOH溶液中2Al+2OH﹣+2H2O═2AlO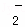 +2H2↑
+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于燃烧热的说法中正确的是()
A. 1 mol物质燃烧所放出的热量
B. 常温下,可燃物燃烧放出的热量
C. 在25℃、1.01×105Pa时,1mol纯物质燃烧生成稳定的氧化物时所放出的热量
D. 燃烧热随化学方程式前的化学计量数的改变而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
今有如下三个热化学方程式:
H2(g)+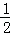 O2(g)═H2O(g)△H=a kJ•mol﹣1
O2(g)═H2O(g)△H=a kJ•mol﹣1
H2(g)+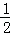 O2(g)═H2O(l)△H=b kJ•mol﹣1
O2(g)═H2O(l)△H=b kJ•mol﹣1
2H2(g)+O2(g)═2H2O(l)△H=c kJ•mol﹣1
关于它们的下列表述正确的是()
A. 它们都是吸热反应 B. a、b和c均为正值
C. a=b D. 2b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
在同温同压下,下列各组热化学方程式中,△H1>△H2的是()
A. 2H2(g)+O2(g)═2H2O(l)△H1;2H2(g)+O2(g)═2H2O(g)△H2
B. S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2
C. C(s)+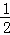 O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
D. H2(g)+Cl2(g)═2HCl(g)△H1;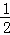 H2(g)+
H2(g)+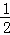 Cl2(g)═HCl(g)△H2
Cl2(g)═HCl(g)△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列问题:
(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为 ;将该反应设计成碱性燃料电池,写出该电池的负极电极反应方程式
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ•mol﹣1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=﹣247.4kJ•mol﹣1
以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 .
(3)已知白磷、红磷燃烧的热化学方程式分别为:
P4(s,白磷)+5O2=P4O10(s);△H=﹣2986kJ•mol﹣1
4P(s,红磷)+5O2=P4O10(s);△H=﹣2956kJ•mol﹣1
则白磷比红磷 (填“稳定”或“不稳定”)
(4)已知一定条件下A2与B2自发反应生成AB3,则反应A2(g)+3B2(g)=2AB3(g) 的△S= 0,△H 0 (填“<”、“>”、“=”)
(5)如图为电解精炼银的示意图, a (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 .
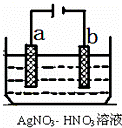
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com