
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1=_________,V2=___________。
(2)根据上表中实验①、②的数据,可以得到的结论是_________________________________。
(3)探究温度对化学反应速率的影响,应选择__________(填实验编号)。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。
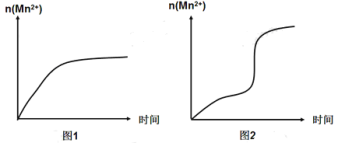
该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
该小组同学提出的假设是___________________________________________。
【答案】2.0 3.0 其他条件不变时,增大(减小)反应物浓度,化学反应速率加快(减慢) ②③ Mn2+对该反应有催化效果
【解析】
(1).利用实验2、3中的数据,可知溶液的总体积为10.0mL,所以实验1中![]() =2.0mL,
=2.0mL,![]() =3.0mL;
=3.0mL;
(2).实验①、②其他条件相同,只有![]() 浓度不同,则实验①、②探究的是浓度对反应速率的影响,根据表中的实验数据,实验①的草酸浓度大,溶液褪至无色所需时问更短,则浓度大,反应速率大;
浓度不同,则实验①、②探究的是浓度对反应速率的影响,根据表中的实验数据,实验①的草酸浓度大,溶液褪至无色所需时问更短,则浓度大,反应速率大;
(3).实验2和③的温度不同,其他条件相同;
(4).由①④可知,反应中的变量为是否加入![]() ,故本实验为验证Mn2+对该反应有催化效果;
,故本实验为验证Mn2+对该反应有催化效果;
(1).利用实验2、3中的数据,可知溶液的总体积为10.0mL,所以实验1中![]() =2.0mL,
=2.0mL,![]() =3.0mL,故答案为:2.0,3.0;
=3.0mL,故答案为:2.0,3.0;
(2) 实验①、②其他条件相同,只有![]() 浓度不同,则实验①、②探究的是浓度对反应速率的影响,根据表中的实验数据,实验①的草酸浓度大,溶液褪至无色所需时间更短,则浓度大,反应速率大故答案为:其他条件不变时,增大(减小)反应物浓度,加快(減慢)化学反应速率;
浓度不同,则实验①、②探究的是浓度对反应速率的影响,根据表中的实验数据,实验①的草酸浓度大,溶液褪至无色所需时间更短,则浓度大,反应速率大故答案为:其他条件不变时,增大(减小)反应物浓度,加快(減慢)化学反应速率;
(3).为探究温度对化学反应速率的影响,必须温度不同,其他条件相同,实验②和③满故答案为:②③;
(4).由①④可知,反应中的变量为是否加入![]() ,故本实验为验证Mn2+对该反应有催化效果;
,故本实验为验证Mn2+对该反应有催化效果;


科目:高中化学 来源: 题型:
【题目】各地对食品非法添加和滥用添加剂进行了多项整治活动。其中常用的面粉增白剂过氧化苯甲酰(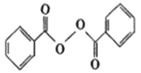 )也被禁用。下面是一种以苯为原料合成过氧化苯甲酰的流程:
)也被禁用。下面是一种以苯为原料合成过氧化苯甲酰的流程:
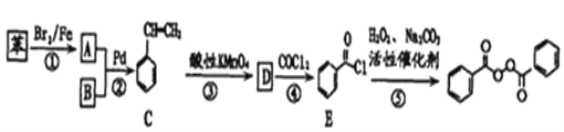
已知:R-X+![]()
请回答下列问题:
(1)结合过氧化苯甲酰结构分析,过氧化苯甲酰可以作为增白剂的原因是___。
(2)写出反应②的化学方程式___。
(3)某物质F为过氧化苯甲酰的同分异构体,同时符合下列条件的F的同分异构体有___种,请写出其中有三种不同化学环境的氢原子的结构简式:___。
①含有联苯(![]() )结构单元,无其他环状结构
)结构单元,无其他环状结构
②在一定条件下能发生银镜反应
③1molF最多可消耗4molNaOH
(4)请写出以苯乙烯为原料,合成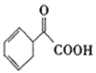 的流程,无机试剂任选,注明反应条件。____。
的流程,无机试剂任选,注明反应条件。____。
示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行
中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从实验装置上看,图中缺少的一种玻璃用品是_____________。
(2)实验中改用60 mL 0.50 mol/L盐酸与60 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量____(填“相等”或“不相等”),所求得的中和热____(填“相等”或“不相等”),简述理由:___________________________________________。
(3)实验中改用6.94 mL 15 mol/L硫酸溶液跟60 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”),简述理由:_____________________________________________________________________
(4)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①3.3 ℃、②3.5 ℃、③4.5 ℃,则最终代入计算式的温差平均值为____℃。
(5)请利用上(4)小题的结论,计算该实验测得的中和反应反应热ΔH=____[设盐酸和NaOH溶液的密度为1 g/cm3,反应后混合溶液的比热容(c)为4.18 J/(g·℃)]。
(6)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和反应反应热为ΔH1,则ΔH1与原题中ΔH的关系为ΔH1____(填“<”“>”或“=”)ΔH,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.碱性锌锰干电池的负极反应式为:MnO2+2H2O-2e=Mn(OH)2+2OH
B.铅蓄电池放电时,正极反应式为PbO2+4H++SO42+2e=PbSO4+2H2O
C.NaHS水解反应方程式:HS+H2O ![]() H3O++S2
H3O++S2
D.过量的SO2通入到漂白粉溶液中,反应方程式:ClO+SO2+H2O=HClO+HSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( )
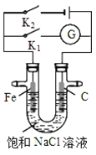
A.K1闭合,石墨棒周围溶液pH逐渐降低
B.K1闭合,铁棒上发生的反应为2H+ + 2e= H2↑
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极保护法
D.K2闭合,电路中通过0.2NA个电子时,两极共产生标况下4.48L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学化学反应原理,解决以下问题:
(1)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,请回答下列问题:
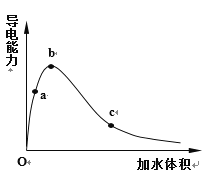
①写出冰醋酸电离方程式____________
②加水过程中,其水溶液导电能力变化的原因是:_______________________________________
③a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:__________(填“相同”、“a点大”、“b点大”、“c点大”)
(2)常温下,将0.2 mol·L-1的CH3COOH和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH=5(溶液体积变化忽略不计),则该溶液中:
c(CH3COO) + c(CH3COOH)= _______mol/L
c(H+) - c(CH3COO)+ c(Na+) = _______mol/L
(3)KAl(SO4)2·12H2O可做净水剂,其原理是____________________________________(用离子方程式表示)
(4)在0.10 mol·L-1 Na2SO3溶液中,离子浓度由大到小的顺序为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3- )(填“>”、“<”或“=”)。
②将浓度均为0.1mol/L的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最小的是__________。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH) =___________。
⑤室温下,某溶液中存在着CH3COOH(aq)+HCO3-( aq)CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K =___________。
⑥室温下,pH =4的CH3COOH与pH =10的CH3COONa溶液中,由水电离出的c(H+)之比_______。
(2)已知室温下Cu(OH)2的Ksp=2×10-20,又知室温下某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于 0.1 mol/L Na2SO3溶液,正确的是( )
A.升高温度,溶液 pH 降低
B.c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)
)+c(H2SO3)
C.c(Na+)+c(H+)=2c(SO![]() )+2c(HSO
)+2c(HSO![]() )+c(OH-)
)+c(OH-)
D.加入少量 NaOH 固体,c(SO![]() )与c(Na+)均增大
)与c(Na+)均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com