
| A. | CO2 | B. | CO | C. | SO2 | D. | Cl2 |
科目:高中化学 来源: 题型:选择题
| A. | MnCl2溶液中常含有Cu2+,可添加难溶电解质MnS除去:Cu2++S2-=CuS↓ | |
| B. | 盛放NaOH溶液的试剂瓶不能用玻璃塞是因为:SiO2+2OH-=SiO32-+H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 向氨水中滴入少量饱和氯化铁溶液制各Fe(OH)3胶体:Fe3++3NH3•H2O?Fe(OH)3(胶体)+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
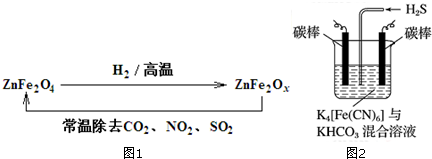
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发结晶时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 过滤时,溶液的液面高于滤纸的边缘 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从上口倒到另一个烧杯中 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热的反应发生时不必加热,吸热反应都需要加热后才能发生 | |
| B. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 | |
| C. | 化学反应一定有能量变化,当△H为“-”时,表示该反应为吸热反应 | |
| D. | 已知C(s)+$\frac{1}{2}$O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
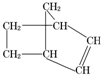 降冰片烯的分子结构如图:
降冰片烯的分子结构如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com