
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是

A. 电池工作时,负极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池充电时间越长,电池中的Li2S2量越多
C. 电解质中加入硫酸能增强导电性
D. 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
【答案】D
【解析】A、由装置图可知,电池工作时Li+向a极移动,则a极为正极,b极为负极,结合电池反应为16Li+xS8=8Li2Sx(2≤x≤8),负极Li的反应式为Li-e-=Li+,所以A错误;B、由总反应可知正极依次发生S8→Li2S8→ Li2S6→Li2S4→Li2S2的还原反应,当充电时,将进行逆向转化,所以充电时间越长,电池中Li2S2量越少,故B错误;C、加入硫酸,将与负极材料Li作用,从而减弱电路的导电性,故C错误;D、该电池的负极反应Li-e-=Li+,所以当电路中流过0.02 mol电子,负极消耗Li的物质的量为0.02mol,其质量为0.14 g,所以D正确。本题正确答案为D。


科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如右。下列说法不正确的是

A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及极性键的断裂与生成
C. 氧化剂与还原剂的物质的量之比为1∶3
D. 原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL.0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.200 mol·L-1NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑NH3·H2O的分解和NH3的挥发)。下列说法不正确的是
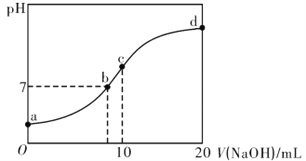
A. 点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)><(OH-)
B. 点b所示溶液中:c(NH4+)+c(Na+)=2c(SO42-)>c(H+)=c(OH-)
C. 点c所示溶液中:c(SO42-)+c(H+)=c(NH3·H2O)+c(OH-)
D. 点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是( )
A. Na2CO3+CaCl2=CaCO3↓+2NaCl
B. Fe+CuSO4=Cu+FeSO4
C. 2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
D. CaO+H2O=Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验装置的正确连接是实验成功的关键,下图是中学化学中常见的实验装置。
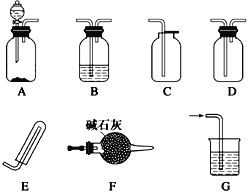
(1)用上述装置制备气体:
①用A、F、D组合能制取并收集的干燥气体是_________________(填字母代号)。
a.H2 b.H2S c.CO2d.C2H2
②要快速制取并得到干燥的NH3,正确的仪器组合是___________[按气体制备(不包括尾气处理)装置顺序填仪器的字母代号,注意集气装置不可倒置],制气所选用的固体药品是_________________(填名称)。
(2)甲同学用A、B组合来验证氯化氢、碳酸、次氯酸的酸性强弱时,盐酸应装入____________(填仪器名称)中,B装置中发生的有明显现象的反应的离子方程式为_____________________________。
(3)为检查如图所示简易气体发生装置的气密性,乙同学进行了相关操作和方案设计。乙同学认为,只要向漏斗中加水,便可检查其气密性是否良好。经检验他的方案可行,则乙同学的操作方案、现象和结论是_____________________________________________。
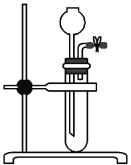
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液时,由于操作不慎,使液面略超过了容量瓶的刻度(标线),这时应采取的措施是( )
A.倾出标线以上的液体
B.吸出标线以上的溶液
C.影响不大,不再处理
D.重新配制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析细胞内4种重要有机物的组成及功能,回答下列问题:
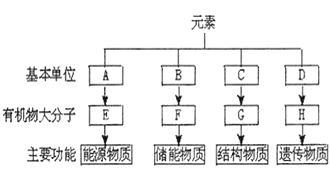
(1)E在动物细胞中是指____,在植物细胞中是指______;组成E的基本单位A是____,可用_____试剂检测。
(2)F是脂肪,可被苏丹Ⅲ染液染成____,脂质还包括____和____等。
(3)C是指______,大约有______种。
(4)生物体内的H主要集中在细胞核内的是______,组成H的基本单位D是_______。
(5)组成E、F、G、H四种有机物共有的元素有_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
![]()

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称____________。
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________。(填正确答案标号)
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________。
(4)在本实验的分离过程中,产物应从分液漏斗的____________。(填“上口倒出”或“下口倒出”)
(5)分离提纯过程中加入无水氯化钙的目的是____________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。(填正确答案标号)
A.圆底烧瓶 B.温度计 C.吸滤器 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________。(填正确答案标号)
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
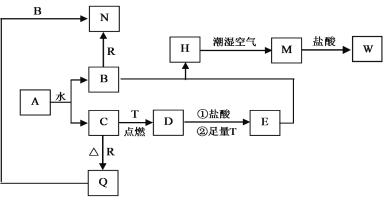
(1)写出下列物质的化学式:A:_______,D:_________,R:____________。
(2)按要求写下列反应方程式:
H在潮湿空气中变成M的过程中的化学方程式____________________;
B和R反应生成N的离子方程式________________________________;
D与盐酸反应的离子方程式_____________________________________。
(3)检验气体C的方法_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com