
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
科目:高中化学 来源: 题型:解答题
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH=1的溶液中:K+、Fe2+、ClO-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液:Cu2+、Na+、SO42-、NO3- | |
| C. | 加入铝粉产生大量氢气的溶液中:Na+、NH4+、NO3-、SO42- | |
| D. | 在0.1 mol•L-1 Fe3+溶液中:K+、Na+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入醋酸钠固体,可抑制醋酸的电离 |
查看答案和解析>>
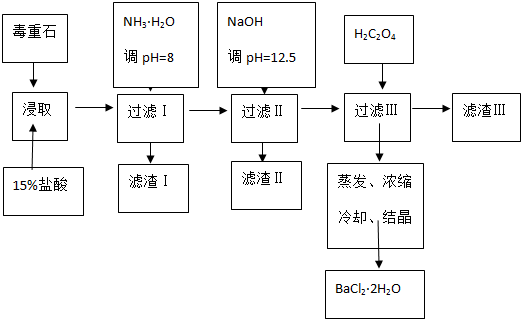
科目:高中化学 来源: 题型:解答题
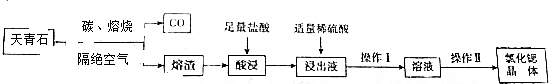
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁元素被氧化,碳元素被还原 | |
| B. | 当有1mol O2参与反应时,消耗$\frac{2}{3}$mol Fe | |
| C. | x=4,y=3 | |
| D. | 每生成1mol FeCO3,转移电子4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮化硅陶瓷、有机玻璃是传统无机非金属材料 | |
| B. | 瓷坩埚能耐高温,可以用于加热分解石灰石 | |
| C. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 | |
| D. | SO2具有氧化性,可用于漂白纸浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油在上层,水在下层,汽油层呈无色 | |
| B. | 汽油在下层,水在上层,汽油层呈紫色 | |
| C. | 汽油在上层,水在下层,水层呈无色 | |
| D. | 汽油在上层,水在下层,水层呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.| 氟 | 氧 | 溴 | 碘 | |
| 第一电离能 (kJ/mol) | 1 681 | 1 251 | 1 140 | 1 008 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com