
【题目】下列依据热化学方程式得出的结论正确的是( )
A.若2CH3OH(1)+3O2(g)═2CO2(g)+2H2O(g)△H=﹣1478KJ/mol,则CH3OH(1)的燃烧热为739KJ/mol
B.若P4(白磷,s)═4P(红磷,s)△H<0,则红磷比白磷稳定
C.已知H+(aq)+OH﹣(aq)═H2O(1)△H=﹣57.3KJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.65KJ的热量
D.已知2C(s)+2O2(g)═2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2;△H1>△H2
【答案】B
【解析】解:A、CH3OH的燃烧热必须是1mol物质生成最稳定的化合物即生成液态水的过程所放出的热量,气态水变为液态水是放热的,所以CH3OH(1)的燃烧热大于739KJ/mol,故A错误;B、P (白磷,s)=P (红磷,s)△H<0,所以红磷的能量低于白磷的能量,所以红磷比白磷稳定,故B正确;
C、在稀溶液中,H+(aq)+OH﹣(aq)═H2O(1)△H=﹣57.3KJ/mol,又 NaOH固体溶于水放热,所以20.0gNaOH的物质的量n= ![]() =0.5nol,与稀盐酸完全中和生成0.5mol水,此时放出热量大于28.65KJ,故C错误;
=0.5nol,与稀盐酸完全中和生成0.5mol水,此时放出热量大于28.65KJ,故C错误;
D、焦炭完全燃烧放出的热量高于不完全燃烧放出的热量,焓变是负值,即△H1<△H2 , 故D错误.
故选B.


科目:高中化学 来源: 题型:
【题目】下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
A.相同浓度溶液的碱性:Na2CO3>NaHCO3
B.在水中的溶解度:Na2CO3>NaHCO3
C.与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3
D.热稳定性:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,2.24L SO3中含有的SO3分子数为0.1NA
B.5.6 g Fe与标准状况下2.24L的Cl2充分反应,转移的电子数为0.3NA
C.将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L
D.1molMnO2与4mol浓盐酸充分反应后生成的Cl2分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)某密闭容器中发生反应:X(g)+Y(g)3Z(g)△H<0如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( ) 
A.t2时加入了催化剂
B.t3时降低了温度
C.t5时增大了压强
D.t4~t5时间内转化率最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关气体摩尔体积的描述中正确的是 ( )
A. 单位物质的量的气体所占的体积就是气体摩尔体积
B. 通常状况下的气体摩尔体积约为22.4L
C. 标准状况下的气体摩尔体积约为22.4L
D. 相同物质的量的气体摩尔体积也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( ) 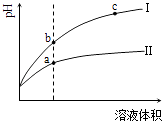
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量是科学研究的重要方法。相同质量的铁与足量稀硫酸分别在下列条件下发生反应,其中化学反应速率最大的是
选项 | 硫酸浓度 | 反应温度 | 铁的状态 |
A | 2.0 mol/L | 20℃ | 块状 |
B. | 0.5 mol/L | 20℃ | 粉末状 |
C. | 1.0 mol/L | 40℃ | 块状 |
D. | 2.0 mol/L | 40℃ | 粉末状 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭).下列说法不正确的是( )
A.倭铅是指金属锌和铅的混合物
B.煤炭中起作用的主要成分是C
C.我国历史上铅的使用早于锌
D.该冶炼锌的方法属于热还原法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com