
| A. | 分别向Na2CO3和NaHCO3溶液中逐滴加入稀盐酸至过量,产生的现象相同 | |
| B. | 分别向AlCl3溶液中逐滴加入NaOH溶液和氨水至过量,产生的现象相同 | |
| C. | 分别将FeO和Fe2O3溶于稀硝酸中,再加入KSCN溶液,溶液的颜色不同 | |
| D. | 分别向FeCl2和MgCl2溶液中,加入NaOH溶液至过量,沉淀的颜色不同 |
分析 A、向Na2CO3中加入稀盐酸至过量,先开始无现象,然后有气泡产生;向NaHCO3溶中加入稀盐酸至过量,立即有气泡产生;
B、向AlCl3溶液中逐滴加入NaOH溶液至过量,先产生白色沉淀,然后沉淀消失;向AlCl3溶液中逐滴加入氨水至过量,产生的白色沉淀不消失;
C、将FeO溶于稀硝酸中,反应生成硝酸铁、一氧化氮和水,将Fe2O3溶于稀硝酸中,反应生成硝酸铁和水,三价铁遇KSCN溶液,溶液变成血红色;
D、向FeCl2溶液中,加入NaOH溶液至过量,先产生白色沉淀,然后白色沉淀变成灰绿色,最终变成红褐色;向MgCl2溶液中,加入NaOH溶液至过量,产生白色沉淀;
解答 解:A、向Na2CO3中加入稀盐酸至过量,先生成碳酸氢钠,无现象,然后碳酸氢钠与盐酸反应生成二氧化碳气体;向NaHCO3溶中加入稀盐酸至过量,碳酸氢钠与盐酸反应生成二氧化碳气体,立即有气泡产生,产生的现象不同,故A错误;
B、向AlCl3溶液中逐滴加入NaOH溶液至过量,先生成氢氧化铝白色沉淀,然后氢氧化铝沉淀与氢氧化钠反应生成偏铝酸钠,沉淀消失;向AlCl3溶液中逐滴加入氨水至过量,产生氢氧化铝白色沉淀,沉淀不消失,产生的现象不同,故B错误;
C、将FeO溶于稀硝酸中,反应生成硝酸铁、一氧化氮和水,三价铁遇KSCN溶液,溶液变成血红色;将Fe2O3溶于稀硝酸中,反应生成硝酸铁和水,三价铁遇KSCN溶液,溶液变成血红色,产生的现象相同,故C正确;
D、向FeCl2溶液中,加入NaOH溶液至过量,先生成氢氧化亚铁白色沉淀,然后氢氧化亚铁被O2氧化,白色沉淀变成灰绿色,最终变成红褐色氢氧化铁沉淀;向MgCl2溶液中,加入NaOH溶液至过量,产生氢氧化镁白色沉淀,沉淀不消失,产生的现象不同,故D错误;
故选C.
点评 本题主要考查了元素及其化合物的性质,难度不大,掌握反应的化学方程式是解题的关键,注意反应物量不同,产物往往不同.


科目:高中化学 来源: 题型:选择题
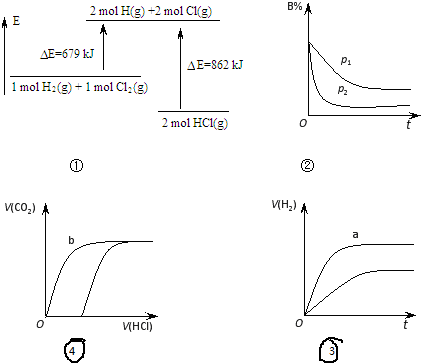
| A. | ①表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183 kJ/mol | |
| B. | ②表示其它条件不变时,反应 4A(g)+3B(g)?2C(g)+6D在不同压强下 B的体积分数随时间的变化,则D一定是气体 | |
| C. | ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a曲线表示CH3COOH溶液 | |
| D. | ④表示分别向同为10 mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,逐滴滴加0.1mol/L 盐酸,所产生CO2的体积随盐酸体积的变化情况,则b曲线表示Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 碱 | 盐 | 氧化物 | |
| A | 硫 酸 | 纯 碱 | 硅酸钠 | 铁 红 |
| B | 氢硫酸 | 烧 碱 | 纯 碱 | 生石灰 |
| C | 碳 酸 | 石 膏 | 小苏打 | 二氧化硫 |
| D | 二氧化碳 | 苛性钠 | 食 盐 | 石灰石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
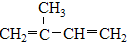 、⑤ClCH=CHCl、
、⑤ClCH=CHCl、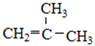 ⑦
⑦ ⑧
⑧ ⑨1,3,5-庚三烯
⑨1,3,5-庚三烯 .
. 中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在.⑨1,3,5-庚三烯的众多链烃同分异构体中:含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的5种.含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”的结构简式是
中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在.⑨1,3,5-庚三烯的众多链烃同分异构体中:含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的5种.含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”的结构简式是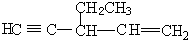 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小;B的原子有6个运动状态不同的电子;D、E两元素同主族,且E的原子核外电子数是D的2倍;F是前四周期中未成对电子数最多的元素;G原子内层轨道全排满电子,最外层电子数为2.根据以上信息,回答下列问题:
现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小;B的原子有6个运动状态不同的电子;D、E两元素同主族,且E的原子核外电子数是D的2倍;F是前四周期中未成对电子数最多的元素;G原子内层轨道全排满电子,最外层电子数为2.根据以上信息,回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | M | |
| A | N2 | NO | NO2 | O2 |
| B | Cl2 | FeCl3 | FeCl2 | Fe |
| C | Al2O3 | NaAlO2 | Al(OH)3 | NaOH |
| D | S | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com