
| A、4 v(NH3)=5v(O2) |
| B、6 v(O2)=5v(H2O) |
| C、4v(NH3)=6 v(H2O) |
| D、v(O2)=4v(NO) |


科目:高中化学 来源: 题型:
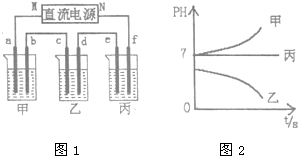 A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②③④ |
| C、②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
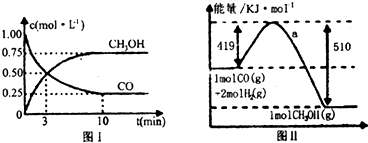
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A、2CN-+H2O+CO2→2HCN+CO32- |
| B、2HCOOH+CO32-→2HCOO-+H2O+CO2↑ |
| C、中和等体积、等c(H+)的HCOOH和HCN消耗NaOH的量前者小于后者 |
| D、相同物质量浓度的HCOONa和NaCN溶液中:c(HCOO-)<c(CN-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤⑥ | B、②③④⑦. |
| C、①③⑤⑦ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工作时,电解质溶液的pH逐渐增大 |
| B、工作时,能见到浅蓝色火焰 |
| C、工作时,H2为正极,O2为负极 |
| D、电极反应式为:负极:2H2+4OH--4e-=4H2O正极:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数小于36的X、Y、Z、W四种元素,其中X是原子半径最小的元素,Y原子基态时s能级上的电子总数是p能级上电子总数的2倍.Z原子基态时2p原子轨道上有3个未成对的电子,W的外围电子构型是3d104s1.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是原子半径最小的元素,Y原子基态时s能级上的电子总数是p能级上电子总数的2倍.Z原子基态时2p原子轨道上有3个未成对的电子,W的外围电子构型是3d104s1.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com