
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效、安全的消毒剂。实验室以NH4Cl、盐酸和NaClO2(亚氯酸钠)为原料制备ClO2的流程如图所示。

请回答下列问题:
(1)ClO2中Cl的化合价是________________________。
(2)写出电解时发生反应的化学方程式:____________________________。
(3)NCl3与NaClO2(亚氯酸钠)反应的化学方程式NCl3+3H2O+6NaC1O2=6ClO2↑+3NaCl+3NaOH+NH3↑,该反应的氧化剂与还原剂的物质的量之比为______;若产生11.2L(标准状况)NH3,则转移电子的总数为___NA。
(4)二氧化氯进行水处理时,除了杀菌消毒外,还能除去水中的Fe3+和Mn2+,写出C1O2将Mn2+氧化为MnO2的离子方程式(C1O2反应后的产物为Cl-):_________________。
【答案】 +4 NH4Cl+2HCl![]() 3H2↑+NCl3 1:6 3 5Mn2++2ClO2+6H2O==5MnO2↓+2Cl-+12H+
3H2↑+NCl3 1:6 3 5Mn2++2ClO2+6H2O==5MnO2↓+2Cl-+12H+
【解析】分析:由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl![]() 3H2↑+NCl3,在NCl3溶液中加入NaClO2发生氧化还原反应,可生成混合气体ClO2和NH3,据此解答。
3H2↑+NCl3,在NCl3溶液中加入NaClO2发生氧化还原反应,可生成混合气体ClO2和NH3,据此解答。
详解:(1)ClO2中氧元素-2价,化合物中化合价代数和为0,则氯元素为+4价;
(2)根据以上分析可知电解时发生反应的化学方程式NH4Cl+2HCl![]() 3H2↑+NCl3;
3H2↑+NCl3;
(3)NCl3与NaClO2(亚氯酸钠)反应的化学方程式为NCl3+3H2O+6NaC1O2=6ClO2↑+3NaCl+3NaOH+NH3↑,该反应中NaClO2中氯元素由+3价升高到ClO2中的+4价,失1个电子,作还原剂,NCl3中的氮元素由+3价生成氨气中的-3价,得电子,作氧化剂,生成1mol氨气转移电子数为6mol,根据电子得失守恒可知该反应的氧化剂与还原剂的物质的量之比为1:6。11.2L氨气的物质的量是0.5mol,转移电子0.5mol×6=3mol,因此产生11.2L(标准状况)NH3,转移电子的总数为3NA;
(4)ClO2氧化除去Mn2+生成MnO2,ClO2反应后的产物为Cl-,因此该反应的离子方程式为5Mn2++2ClO2+6H2O=5MnO2↓+2Cl-+12H+。


科目:高中化学 来源: 题型:
【题目】下面有关金属的叙述正确的是( )
A. 金属原子只有还原性而其阳离子只有氧化性
B. 金属阳离子只存于化合物中且有相应的阴离子相配合
C. 金属单质在氧化还原反应中只能做还原剂
D. 若某单质具有延展性,则它一定是金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用容量瓶配制溶液时,由于操作不当会引起误差,下列情况会使所配溶液偏高的是
A. 定容时,俯视容量瓶的刻度线
B. 转移溶液前容量瓶内有少量蒸馏水
C. 溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
D. 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
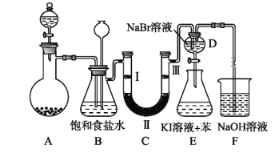
(1) 制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:_____________。
装置B中饱和食盐水的作用是___________________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象____________________________________。
(2) 装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入__________。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3) 设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,离子反应方程为:_______________________,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是__________________________________。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料,在纺织、造纸、化工合成方面都有重要的用途。
(1)工业上电解饱和食盐水制取氯气:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,理论上每转移1mol电子,生成的氯气在标准状况下的体积为___L。工业上将生成的氯气通入石灰乳制取漂白粉,请写出该反应的化学方程式___________
2NaOH+H2↑+Cl2↑,理论上每转移1mol电子,生成的氯气在标准状况下的体积为___L。工业上将生成的氯气通入石灰乳制取漂白粉,请写出该反应的化学方程式___________
(2)实验室用常用MnO2与浓盐酸共热制氯气,试写出该反应的化学方程式_____________________,若用100mL12mol·L-1的浓盐酸与足量的MnO2反应,则生成的氯气在标准状况下的体积_____6.72L(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2 B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2 D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO![]() +5e﹣+8H+===Mn2++4H2O
+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为______(标准状况),被氧化的HCl的物质的量为____。
(5)除去镁粉中混入的铝粉杂质用溶解、_______方法,化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型镁铝合金(Mg17Al12)有储氢性能,它一定条件下完全吸氢的反应为Mg17Al12+17H2═17MgH2+12Al,得到的混合物Y(17MgH2+12Al)能与酸反应释放出大量氢气.下列说法正确的是
A. 该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
B. 合金在吸氢过程中被H2还原
C. 一定量的镁铝合金既可以完全溶于足量盐酸中,也可以完全溶于足量的NaOH溶液中
D. 等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)由大到小的顺序为:V(Mg)> V(合金)>V(铝)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:

请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________。
(3)写出实验④中A点对应沉淀的化学式:__________。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com