
CO2的回收利用对减少温室气体排放、改善人类生存环境具有重要意义。利用CO2和CH4重整可制合成气(主要成分CO、H2),重整过程中部分反应的热化学方程式为: ①CH4(g) = C(s) + 2H2(g) △H = +75.0 kJ·mol-1
②CO2(g) + H2(g) = CO(g) + H2O(g) △H = +41.0 kJ·mol-1
③CO(g) + H2(g) = C(s) + H2O(g) △H = -131.0 kJ·mol-1
(1)反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g)的△H= ___________。
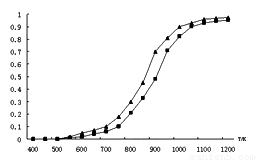
(2)固定n(CO2)= n(CH4),改变反应温度,CO2和CH4的平衡转化率见下图。
①同温度下CO2的平衡转化率 ____________(填“大于”或“小于”)于CH4的平衡转化率,其原因是 __________________________。
②高温下进行该反应时常会因反应①生成“积碳”(碳单质),造成催化剂中毒,高温下反应①能自发进行的原因是_________________。
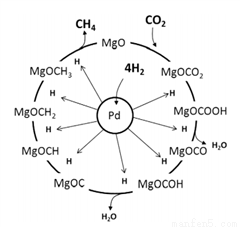
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,该反应的化学方程式为_____________________,反应过程中碳元素的化合价为-2价的中间体是__________。
(4)卤水可在吸收烟道气中CO2的同时被净化,实现以废治废,其中涉及的一个反应是CaSO4 + Na2CO3 == CaCO3 + Na2SO4,则达到平衡后,溶液中c(CO32-)/c(SO42-) = __________。【用Ksp(CaSO4)和Ksp(CaCO3)表示】
科目:高中化学 来源:2016-2017学年福建省高一下学期开学考试化学试卷(解析版) 题型:选择题
用右图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是
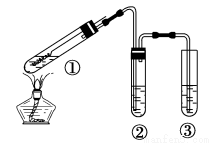
A. 上下移动①中铜丝可控制SO2的产生与停止
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认有CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
下列各组会出现先产生沉淀,然后沉淀再溶解的现象的是
A. 向NaOH溶液中逐滴滴入Al2(SO4)3溶液至过量
B. 向NaAlO2溶液中通入CO2气体至过量
C. 向NaHCO3溶液中逐滴滴入NaOH溶液至过量
D. 向NaAlO2溶液中逐滴滴入盐酸至过量
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三2月月考理科综合化学试卷(解析版) 题型:填空题
(1)甲烷在一定条件下可生成以下微粒:
A. 碳正离子(CH3+ ) B.碳负离子(CH3—)C. 甲基 (﹣CH3) D.碳烯 (:CH2)
①四种微粒中,键角为120°的是_____(填序号).
②碳负离子(CH3—)的空间构型为______,与CH3—互为等电子体的一种分子是__(填化学式)
(2)在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学方程式为(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为_________.
②写出基态Cu2+的价电子排布式_____________.
③化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为___________.
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为__;1mol尿素分子中,σ 键的数目为______________.
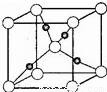
⑤Cu与O元素形成的某种化合物的晶胞结构如图所示,若阿伏伽德罗常数为NA,晶胞的边长为a pm,则氧元素对应的离子在该晶胞中的坐标是_____,该晶体的密度为__g•cm﹣3.
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三2月月考理科综合化学试卷(解析版) 题型:选择题
短周期元素a、b、c、d原子序数依次增大。a的核外电子总数与其周期数相同,b的某种单质是空气的主要成分,c的最外层电子数为其内层电子数的3倍,d与c同族;下列说法错误的是( )
A. a、b、d均可以与c形成两种或多种二元化合物
B. 阴离子的还原性d大于c
C. a与d形成的化合物可以抑制水的电离
D. 常温下,由这四种元素构成的某种盐的溶液pH=4,则水电离出的H+浓度肯定是1×10-4mol/L
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
80℃时,NO2(g)+SO2(g) SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol ·L-1 | 0.10 | 0.20 | 0.20 |
c(SO2)/mol ·L-1 | 0.10 | 0.10 | 0.20 |
A. 平衡时,乙中SO2的转化率大于50%
B. 当反应平衡时,丙中c(SO2)是甲中的2倍
C. 温度升至90℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol ·L-1 NO2和0.20 mol ·L-1 SO2,达到平衡时c(NO)与原平衡不同
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A. Al2O3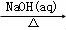 NaAlO2(aq)
NaAlO2(aq)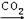 Al(OH)3
Al(OH)3
B. S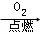 SO3
SO3 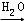 H2SO4
H2SO4
C. Mg(OH)2 MgCl2(aq)
MgCl2(aq) 无水MgCl2
无水MgCl2
D. Fe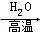 Fe2O3
Fe2O3  FeCl3
FeCl3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省长沙市高二下学期第一次模块检测化学试卷(解析版) 题型:选择题
在一定温度下,将气体X和Y各1.6mol充入10L恒容密闭容器中,发生如下反应:
X(g)+ Y(g) 2Z(g),在反应过程中,X的物质的量与时间的关系如下表所示:
2Z(g),在反应过程中,X的物质的量与时间的关系如下表所示:
t/min | 0 | 2 | 4 | 6 | 8 | …… | 16 | 18 |
n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | …… | …… | 1.000 | 1.000 |
下列说法不正确的是( )
A. 4~6min时间段内Z的平均反应速率为2.5×10-3mol/(L·min)
B. 此温度下该反应的平衡常数K=1.44
C. 达平衡后,升高温度, 减小,则正反应
减小,则正反应
D. 若保持其他条件不变,再充入1.6mol Z,达新平衡后Z的体积分数不变
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:推断题
塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料.添加塑化剂(DBP)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害.其合成线路图如图I所示:
已知以下信息:①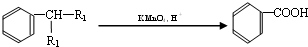
② (-R1、R2表示氢原子或烃基)
(-R1、R2表示氢原子或烃基)
③C为含两个碳原子的烃的含氧衍生物,其核磁共振氢谱图如图Ⅱ所示

(1)C的结构简式为______________,E中所含官能团的名称是______________;
(2)写出下列有关反应的化学方程式:
①E和H2以物质的量比1:1反应生成F:______________;
②B和F以物质的量比1:2合成DBP:______________;该反应的反应类型为______________;
(3)同时符合下列条件的B的同分异构体有______________种,写出其中任意两种同分异构体的结构简式______________。
①不能和NaHCO3溶液反应
②能发生银镜反应
③遇FeC13溶液显紫色
④核磁共振氢谱显示苯环上只有一种氢原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com