
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
分析 ①非金属性越强,对应氢化物越稳定;
②非金属性越强,对应氢化物的还原性越弱;
③相对分子质量越大,沸点越高,但氨气分子间含氢键;
④非金属性越强,对应最高价含氧酸的酸性越强.
解答 解:①非金属性越强,对应氢化物越稳定,则热稳定性:HF>H2O>H2S,故错误;
②非金属性越强,对应氢化物的还原性越弱,则还原性:HI>HBr>HCl,故正确;
③相对分子质量越大,沸点越高,氨气分子间含氢键,则熔沸点:NH3>AsH3>PH3,故错误;
④非金属性越强,对应最高价含氧酸的酸性越强,则酸性:HNO3>H2CO3>H2SiO3,故正确;
故选C.
点评 本题考查元素周期表及元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的表述不正确的是( )
的表述不正确的是( )| A. | 该物质能发生缩聚反应 | |
| B. | 该物质的核磁共振氢谱上共有7个峰 | |
| C. | 该物质遇FeCl3溶液显色 | |
| D. | 1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移溶液时,没有洗涤玻璃棒和溶解用的烧杯 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 定容时观察液面俯视 | |
| D. | 胶头滴管加水定容时,有少量水滴到容量瓶外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
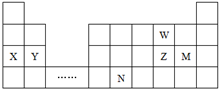
| A. | 离子半径:W2->Y2+ | |
| B. | 电解X与Z形成的化合物的水溶液,不能得到X单质 | |
| C. | 碘的氢化物酸性比M的氢化物酸性弱 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成1 mol N2,电子转移总数为3NA | B. | 生成1 mol N2,电子转移总数为5NA | ||
| C. | 溶解1 mol Zn,电子转移总数为2NA | D. | 溶解1 mol Zn,电子转移总数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀 | |
| B. | 滴入适量FeCl3溶液,溶液变黄,但无沉淀生成 | |
| C. | 测得反应后溶液中Na+与Cl-的个数比为1:1 | |
| D. | 滴入几滴酚酞试液,酚酞试液不变色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com