
【题目】碘化钠在有机合成中用途广泛,工业制备碘化钠有多种方法,下图是制备碘化钠的两种方案。已知:3I2+6NaOH=5NaI+NaIO3+3H2O;N2H4·H2O的沸点118℃,100℃开始分解。
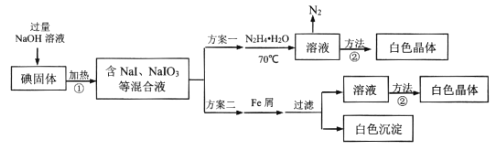
(1)方案一中加入N2H4·H2O后发生的离子反应为:2IO3-(aq)+3N2H4·H2O(l)=2I-(aq)+3N2(g)+7H2O(l) △H<0;部分装置如图1所示。
①图1中仪器b的名称为___。若要使分液漏斗中的液体流入三颈烧瓶中,具体的操作是___。
②实验过程中需控制反应温度70℃左右的原因是___。图1中加热的方式最好选用____。
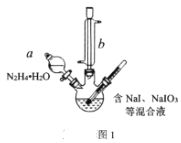
(2)结合NaI溶解度曲线(如图2),流程图中方法②的具体操作为:加热蒸发、___、过滤、洗涤得到白色晶体。
(3)写出方案二中加入Fe屑后的离子方程式_____。
(4)方案二比方案一得到产品的产率略低,其原因是____。
【答案】冷凝管 先打开分液漏斗的玻璃塞,再缓慢旋开活塞 温度过高,N2H4·H2O分解及挥发,温度过低反应太慢 水浴加热 冷却结晶 3H2O+3Fe+IO3-=3Fe(OH)2↓+I- 沉淀未洗涤
【解析】
(1)为了使分液漏斗中液体顺利流下,要先打开分液漏斗的玻璃塞,平衡气压;控制温度既要考虑温高造成的影响,也要考虑温低造成的影响;
(2)溶解度曲线的重要用途之一就是用来判断是否可以采用降温结晶法;
(3)“左顾右盼”判断出部分的反应物和生成物;
(4)对比两个方案流程的差异,流程二进行了晶体的洗涤,因NaI易溶于水,会造成部分NaI溶解损耗。
(1)①仪器b的名称是(直形)冷凝管;若要使分液漏斗中的液体流入三颈烧瓶,具体的操作是:先打开分液漏斗的玻璃塞,再缓慢地旋开活塞;先打开玻璃塞,是为了平衡气压,便于液体顺利流下;
②实验过程中需控制反应温度在70℃左右,原因是温度过高N2H4·H2O分解及挥发加剧,温度过低则反应太慢;图I中加热方式最好选用水浴加热;
(2)NaI的溶解度曲线表明:NaI的溶解度随着温度的升高显著增大。流程图中方法②是从溶液中获得NaI晶体,首先是通过加热蒸发浓缩,将NaI溶液由不饱和溶液变为(过)饱和溶液,然后降温(冷却)结晶,然后过滤、洗涤、干燥即可;
(3)含NaI、NaIO3、NaOH等的混合液,加入铁屑后,IO3-被反应掉,生成了I-,从生成白色沉淀知道铁反应后生成了Fe(OH)2,反应的离子方程式为:3Fe+IO3-+3H2O=3Fe(OH)2↓+I-;
(4)方案二比方案一得到的产品的产率略低,是因为方案一从溶液中直接得到了沉淀,未经洗涤,而方案二在题给的方法②描述中明确提到了洗涤。


科目:高中化学 来源: 题型:
【题目】我国成功研发一种新型铝-石墨双离子电池,这种新型电池采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池总反应为Cx(PF6) +LiAl![]() xC + PF6-+Li+ +Al。该电池放电时的工作原理如图所示。下列说法不正确的是( )
xC + PF6-+Li+ +Al。该电池放电时的工作原理如图所示。下列说法不正确的是( )
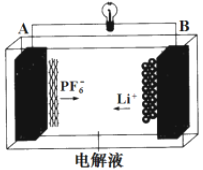
A.放电时,B极的电极反应为LiAl-e-=Li+ +Al
B.Li2SO4溶液可作该电池的电解质溶液
C.充电时A极的电极反应式为xC + PF6--e-=Cx(PF6)
D.该电池放电时,若电路中通过0.01 mol电子,B电极减重0.07 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0mol·L-1的NaOH溶液480mL。
(1)配制时,必须使用的玻璃仪器有___。
(2)要完成本实验该同学应称出NaOH__g。
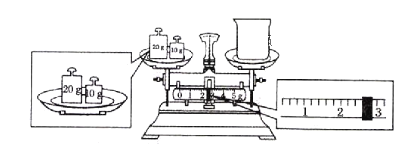
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为__g。(砝码一个20克、一个10克)
(4)使用容量瓶前必须进行的一步操作是__。
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是__。
①没有洗涤烧杯和玻璃棒
②定容时俯视刻度线
③未冷却到室温就将溶液转移到容量瓶并定容
④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用,它与二氧化碳反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:
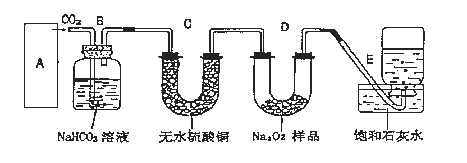
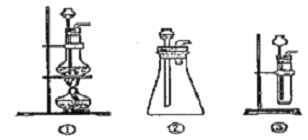
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图:___。
B装置的作用是___,C装置内可能出现的现象是___。为了检验E中收集到的气体,在取出集气瓶后,检验方法是___。
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因:___。(用离子反应方程式表示)。
(3)反应完毕时,若测得E中的集气瓶收集到的气体为260mL,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值___(答大或小),相差___mL(取整数值,所用数据均在标准状况下测定),这是由于____。
(4)你认为上述A-E的实验装置中,E部分是否安全、合理?___(答是或否),理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L三氯甲烷中含氢原子数为0.1 NA
B.0.1mo1L-1 Na2SO3溶液中,含硫元素的粒子数目之和为0.1NA
C.8.0gNH4NO3发生反应5NH4NO3= 4N2+2HNO3+9H2O,转移电子数为0.3 NA
D.0.1mo1P35Cl3与足量37Cl2发生反应:PCl3+Cl2![]() PCl5,产物中P—37Cl键数为0.2 NA
PCl5,产物中P—37Cl键数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学碘硫循环可用于大规模制氢气,HI分解和SO2水溶液还原I2均是其中的主要反应。回答下列问题:
(1)碘硫热化学循环中,SO2的水溶液还原I2的反应包括:SO2+I2+2H2O![]() 3H++HSO4- +2I- 、I-+I2
3H++HSO4- +2I- 、I-+I2![]() I3-。若起始时n(I2)=n(SO2)=1mo1,I- 、I3- 、H+ 、HSO4-的物质的量随(
I3-。若起始时n(I2)=n(SO2)=1mo1,I- 、I3- 、H+ 、HSO4-的物质的量随(![]() )的变化如图所示:
)的变化如图所示:
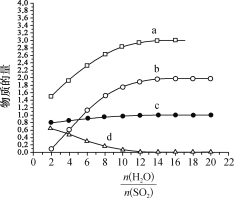
图中表示的微粒:a为_____________,d为____________________。
(2)起始时 HI的物质的量为1mo1,总压强为0.1MPa下,发生反应 HI(g) ![]()
![]() H2(g)+
H2(g)+![]() I2(g) 平衡时各物质的物质的量随温度变化如图所示:
I2(g) 平衡时各物质的物质的量随温度变化如图所示:
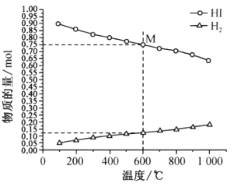
①该反应的△H __________________ (“>”或“<”)0。
②600℃时,平衡分压p(I2)= ______MPa,反应的平衡常数Kp=_____________ (Kp为以分压表示的平衡常数)。
(3)反应 H2(g)+I2(g) ![]() 2HI(g)的反应机理如下:
2HI(g)的反应机理如下:
第一步:I2![]() 2I(快速平衡)
2I(快速平衡)
第二步:I+H2![]() H2I(快速平衡)
H2I(快速平衡)
第三步:H2I+I ![]() 2HI (慢反应)
2HI (慢反应)
①第一步反应_____________ (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= ________(用含k1、k-1、k2…的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池由于具有较高的比能量而成为未来电动汽车的希望。其原理模型如图所示,下列说法不正确的是

A. 可以用LiOH溶液做电解质溶液
B. 锂既是负极材料又是负极反应物
C. 正极反应为2Li+ + O2 + 2e- ![]() Li2O2
Li2O2
D. 正极采用多孔碳材料是为了更好的吸附空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+
已知该反应的速率随c(H+)的增大而加快。下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图。下列说法中不正确的是
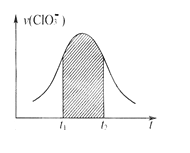
A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合
C. 纵坐标为v(H+)的v-t曲线与图中曲线完全重合
D. 后期反应速率下降的主要原因是反应物浓度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com