
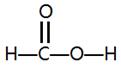 ,所以碳原子采取的是sp2杂化。因为双键是由1δ键个和1个π键组成的,所以该化合物中δ键和π键的个数之比是4:1。
,所以碳原子采取的是sp2杂化。因为双键是由1δ键个和1个π键组成的,所以该化合物中δ键和π键的个数之比是4:1。

科目:高中化学 来源:不详 题型:填空题
| | A | B | C | D | E | F |
| 主要化合价 | -1 | -3 +5 | -2 +6 | -1 +7 | +2 | +1 +2 |
| 原子半径 | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
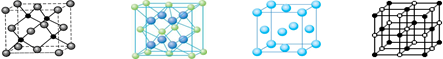

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CCl4层显紫色是因为有I2生成 |
| B.CCl4层颜色变浅是因为I2变成I- |
| C.CCl4层显紫色是因为有Cl2生成 |
| D.CCl4层颜色变无色是因为I2的升华 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④ | B.②③④ | C.①②③ | D.都正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


| A.金刚石和石墨的熔点肯定要比C60高 |
| B.熔点比较:C60<C70<C90 |
| C.球碳分子、管状碳分子、洋葱状碳分子都是分子晶体,都是碳的同素异形体 |
| D.金刚石、石墨晶体属原子晶体;C60、C70、管状碳分子和洋葱状碳分子均属分子晶体。两类不是同素异形体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
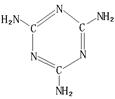
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com