
��������Ҫ�Ļ���ԭ��
��1����֪�� N2��g��+O2��g��=2NO��g�� ��H= +180.5kJ·mol-1
4NH3��g��+5O2��g��=4NO��g��+6H2O��g�� ��H= -905kJ·mol-1
2H2��g��+O2��g��=2H2O��g�� ��H= -483.6kJ·mol-1
д�������ڸ��¸�ѹ�������������ɵ������������Ȼ�ѧ����ʽ�� �������1L�ܱ������У�3mol NH3 �ڵ��������³�ַ�Ӧ��2min��ﵽƽ�⣬ƽ��ʱ�ķ�Ӧ��Ϊ92.4kJ ���������ʱ����v(H2)= �������¶Ȳ��䣬����ʼNH3�����ʵ�������Ϊ8mol��ƽ��ʱNH3��ת����Ϊ ��
��2�������ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ����д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��ѧ�����ô�ԭ������Ƴɰ���һ����ȼ�ϵ�أ���ͨ�백���ĵ缫�� ����������������������������£��õ缫������Ӧ�ĵ缫��ӦʽΪ ��
��3��һ�������£�ij�ܱ������з�����Ӧ��4NH3��g��+5O2��g�� 4NO��g��+6H2O��g������һ��������ܱ������У�Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ������д�ʩ�пɲ��õ��� ������ĸ���ţ���
4NO��g��+6H2O��g������һ��������ܱ������У�Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ������д�ʩ�пɲ��õ��� ������ĸ���ţ���
a������ѹǿ b���ʵ������¶� c������O2��Ũ�� d��ѡ���Ч����
��4�����ij��ˮ�ĵ���̶�Ϊ1%��Ũ��Ϊ0.01 mol/LMgCl2��Һ�μӰ�ˮ����ʼ��������ʱ(��������Һ����仯)����Һ�е�NH3·H2O��Ũ��Ϊ {��֪Ksp[Mg(OH)2]=4.0��10-12]}
��֪ʶ�㡿��˹����Ӧ�� ԭ���ԭ�� Ӱ�컯ѧƽ������ F2 F3 G2
���𰸽�������1��2NH3��g��  N2��g��+ 3H2��g�� ��H �� +92.4 kJ · mol-1 ����2�֣�1.5mol.L-1.min-1 50%��3�֣�
N2��g��+ 3H2��g�� ��H �� +92.4 kJ · mol-1 ����2�֣�1.5mol.L-1.min-1 50%��3�֣�
��2��4NH3+3O2 2N2+6H2O�� ��2�֣�������1�֣�2NH3+6OH-6e��= N2+6H2O ��2�֣�
2N2+6H2O�� ��2�֣�������1�֣�2NH3+6OH-6e��= N2+6H2O ��2�֣�
��3��C��2�֣� ��4��0.002 mol/L��2�֣�
��������1���� N2��g��+O2��g��=2NO��g�� ��H= +180.5kJ·mol-1
�� 4NH3��g��+5O2��g��=4NO��g��+6H2O��g�� ��H= -905kJ·mol-1
�� 2H2��g��+O2��g��=2H2O��g�� ��H= -483.6kJ·mol-1
���ø�˹���ɣ��ڡ�1/2-��-�ۡ�3/2�ã�2NH3��g��  N2��g��+ 3H2��g�� ��H �� +92.4 kJ · mol-1 ����1L�ܱ������У�3mol NH3 �ڵ��������³�ַ�Ӧ��2min��ﵽƽ�⣬ƽ��ʱ�ķ�Ӧ��Ϊ92.4kJ ��˵����2Ħ��NH3�����ֽ⣬��H23Ħ�����������ʱ����v(H2)=3mol/L��2min=1.5mol.L-1.min-1
N2��g��+ 3H2��g�� ��H �� +92.4 kJ · mol-1 ����1L�ܱ������У�3mol NH3 �ڵ��������³�ַ�Ӧ��2min��ﵽƽ�⣬ƽ��ʱ�ķ�Ӧ��Ϊ92.4kJ ��˵����2Ħ��NH3�����ֽ⣬��H23Ħ�����������ʱ����v(H2)=3mol/L��2min=1.5mol.L-1.min-1
�����1L�ܱ������У�3mol NH3 �ڵ��������³�ַ�Ӧ��ƽ��ʱ�ķ�Ӧ��Ϊ92.4kJ��˵����Ӧ�İ���Ϊ2mol��
2NH3��g��⇌N2��g��+3H2��g����H=+92.4 kJ•mol-1��
��ʼ����mol�� 3 0 0
�仯����mol�� 2 1 3
ƽ������mol�� 1 1 3
K=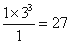
�����¶Ȳ��䣬ƽ�ⳣ�����䣬����ʼNH3�����ʵ�������Ϊ8mol����ת���İ������ʵ���Ϊx
2NH3��g��⇌N2��g��+3H2��g����H=+92.4 kJ•mol-1��
��ʼ����mol�� 8 0 0
�仯����mol�� x 0.5x 1.5x
ƽ������mol�� 8-x 0.5x 1.5x
K= ,���x=4
,���x=4
ƽ��ʱ������ת����: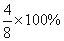 =50%
=50%
��2�������ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ����Ӧ�Ļ�ѧ����ʽ��4NH3+3O2 2N2+6H2O��ȼ���ڸ�������������Ӧ����ͨ�백���ĵ缫�Ǹ��������������£��õ缫������Ӧ�ĵ缫��ӦʽΪ��2NH3+6OH--6e-=N2+6H2O��
2N2+6H2O��ȼ���ڸ�������������Ӧ����ͨ�백���ĵ缫�Ǹ��������������£��õ缫������Ӧ�ĵ缫��ӦʽΪ��2NH3+6OH--6e-=N2+6H2O��
��3��4NH3��g��+5O2��g��⇌4NO��g��+6H2O��g������һ��������ܱ������У�Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ���
a����Ӧ�������������ķ�Ӧ������ѹǿ����Ӧ��������ƽ��������У���a�����ϣ�
b����Ӧ�Ƿ��ȷ�Ӧ���ʵ������¶ȣ���Ӧ��������ƽ��������У���b�����ϣ�
c������O2��Ũ�ȣ�ƽ��������У���Ӧ��������c���ϣ�
d��ѡ���Ч����ֻ�ܸı仯ѧ��Ӧ���ʣ������ı仯ѧƽ�⣬��d�����ϣ�
�ʴ�Ϊ��c��
��4��Ksp=c��Mg2+����c2��OH-��=4.0��10-12 ��c��Mg2+��=0.01mol/L����c��OH-��=2��10-5mol/L������ˮ��Ũ��: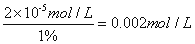
��˼·�㲦�����⿼�����Ȼ�ѧ����ʽ��˹����Ӧ�ã�ԭ���ԭ���͵缫��Ӧ��дӦ�ã�Ӱ�컯ѧƽ�����ط����жϣ�������ʺ��ܶȻ������ļ������⡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ײ�����ȱλ������(MFe2Ox��3<x<4��M=Mn��Zn��Ni�Ҿ���+2������ͬ)��������(MFe2O4)�����»�ԭ���á������£�����ʹ��ҵ�����е�����������ֽ��ȥ��ת��������ͼ��ʾ��
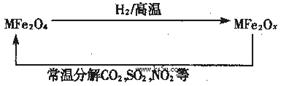
(1)��֪������(MFe2O4)��H2���»�ԭʱ��������Ӧ��MFe2O4��H2�����ʵ���֮��Ϊ 2︰1����ԭ���� MFe2Ox ��x=______��MFe2Ox ��+2������+3��������֮��Ϊ_____��
(2)��������Һ����Fe2O42����ת��ΪFe2��:Fe2O42����2e����8H����2Fe2����4H2O�� KMnO4��Na2CO3��Cu2O��Fe2(SO4)3 ���������е�һ����ʹ������ԭ���̷�����д����������ԭ��Ӧ�����ӷ���ʽ����ƽ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�±���A��B�����л�����й���Ϣ��
| A | B |
| ����ʹ������Ȼ�̼��Һ��ɫ�� �ڱ���ģ��Ϊ
������ˮ��һ�������·�Ӧ | ����C��H����Ԫ����ɣ� �����ģ��Ϊ
|
���ݱ�����Ϣ�ش��������⣺
(1)A��������Ȼ�̼��Һ��Ӧ�����������ƽ���______________________________��
д����һ�������£�A���ɸ߷��ӻ�����Ļ�ѧ��Ӧ����ʽ��__________________��
(2)A�����������ӳɷ�Ӧ������C����C�ڷ�����ɺͽṹ�����Ƶ��л�����һ����(�׳ơ�ͬϵ�)�����Ǿ�����ͨʽCnH2n��2����n��_______ʱ�������л��↑ʼ����ͬ���칹�塣
(3)B���е�������________(�����)������ɫ��ζҺ�塢���ж����۲�����ˮ�����ܶȱ�ˮ����ʹ����KMnO4��Һ����ˮ��ɫ�����κ������²���������Ӧ��
д����Ũ���������£�B��Ũ������50��60 �淴Ӧ�Ļ�ѧ����ʽ��
________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��̬��������������������ܶ�Ϊ27��ȡ0.54 g����ǡ����Ũ��Ϊ0.2 mol��L��1����ˮ100 mL��ȫ��Ӧ��ʹ��ˮ��ȫ��ɫ��������ķ���ʽΪ(����)
A��C4H6 B��C4H8
C��C4H10 D������ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�����л������������Ϊ��Ǧ���͵Ŀ����������ʽ��Ϊ88.0����C����������Ϊ0.682����H����������Ϊ0.136��
(1)��ȷ���û�����ķ���ʽ_____________________________________________________��
(2)��������ͺ˴Ź���������ʾ�÷�������4��������д����ṹ��ʽ
________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йؽ�����ʴ�������˵����ȷ����
A�������Ի����£�����ֻ�ܷ������ⸯʴ
B��������ʴ��ʵ���ǽ���ʧȥ���ӱ���ԭ�Ĺ���
C���ִ��Ĵ���ˮ�����³�װ��һЩп�飬������������������������������
D��ͭ�����Ӵ����ڳ�ʪ�Ŀ�����ֱ�ӷ�����Ӧ��Fe��3e��===Fe3�����̶��γ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���мס��ҡ���������װ���з����ķ�Ӧ���й�˵����ȷ����
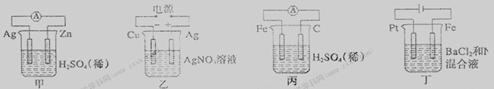
A.���и�����ӦʽΪ2H��+2e - =H2�� B.���е��һ��ʱ�䣬��Һ������������
C.����H+��̼�������ƶ� D.���е�ʼʱ������������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʵ���Ϊ4mol��Na2O2��Al2��SO4��3�Ļ����Ͷ������ˮ�У���ַ�Ӧ������y mol������y��0��������x��ʾԭ�������Na2O2�����ʵ������Խ���y=f��x���ĺ�����ϵʽ����x��ȡֵ��y=f��x����ϵʽ��д�ڱ��ڣ��ɲ�������Ҳ�ɲ��䣩��
| ��� | xֵ | y=f��x�� |
| �� | ||
| �� | ||
| �� | ||
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и�����������ָ�������д���������ǣ� ��
A����c(HCO3��)=0.1 mol·L-1����Һ�У�NH4+��AlO2����Cl����NO3��
B������ˮ�������c(H+)=1��10-12 mol·L-1����Һ�У�Fe2+��ClO����Na+��SO42��
C���ڼ������۲���H2����Һ�У�SO42����NO3����Na+��NH4+
D����ʹ��ɫʯ����ֽ��������Һ�У�SO32����CO32����Na+��K+
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com