
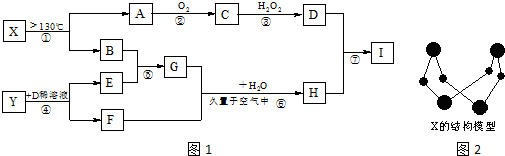
 ��
������ AΪ����ɫ���嵥�ʣ���������Ӧ����C����C����Է���������A��32����AΪS��CΪSO2��DΪH2SO4��HΪ���ɫ������ӦΪFe��OH��3����IΪFe2��SO4��3��Y��F��H��I������ͬ��Ԫ�أ�˵��YΪFe����D��ϡ��Һ��Ӧ���ɵķǽ�������EΪH2��F�к���Fe2+��G��ҺӦ�ʼ��ԣ�ӦΪNH3����BΪN2���ɽṹʽ��֪XΪS4N4���ݴ˽��
��� �⣺AΪ����ɫ���嵥�ʣ���������Ӧ����C����C����Է���������A��32����AΪS��CΪSO2��DΪH2SO4��HΪ���ɫ������ӦΪFe��OH��3����IΪFe2��SO4��3��Y��F��H��I������ͬ��Ԫ�أ�˵��YΪFe����D��ϡ��Һ��Ӧ���ɵķǽ�������EΪH2��F�к���Fe2+��G��ҺӦ�ʼ��ԣ�ӦΪNH3����BΪN2���ɽṹʽ��֪XΪS4N4��
��1�������Ϸ�����֪XΪS4N4���ʴ�Ϊ��S4N4��
��2��GΪNH3������ʽΪ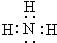 ���ʴ�Ϊ��
���ʴ�Ϊ��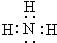 ��
��
��3����Ӧ��ΪSO2��H2O2�ķ�Ӧ����Ӧ����ʽΪ��SO2+H2O2=H2SO4���ʴ�Ϊ��SO2+H2O2=H2SO4��
��4��SO2���л�ԭ�ԣ�Fe3+���������ԣ����߷���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ��2Fe3++SO2+2H2O=2Fe2++SO42-+4H+��
�ʴ�Ϊ��2Fe3++SO2+2H2O=2Fe2++SO42-+4H+��
���� ���⿼��������ƶϣ���A����ɫ����ת����HΪ���ɫ�����������ƶ�ͻ�ƿڣ���Ҫѧ����������Ԫ�ػ�����֪ʶ���߱�һ�����������Ѷȣ��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
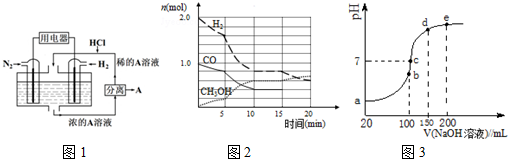
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3.36L | B�� | 1.12L | C�� | 2.24L | D�� | 4.48L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
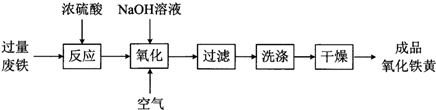
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ��ʾij���ȷ�Ӧ�ֱ����С�������������·�Ӧ�����е������仯 | |
| B�� |  ��ʾ��Mg2+��Al3+��NH4+������Һ�еμ�NaOH��Һʱ�����������ʵ�����NaOH��Һ����Ĺ�ϵ�����������ӵ����ʵ���֮�ȱ�Ϊ��Mg2+������Al3+����n��NH4+��=2��3��2 | |
| C�� | 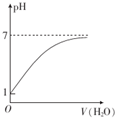 ��ʾ������0.10 mol•L-1��CH3COOH��Һ��ˮϡ��ʱ��Һ��pH�仯 | |
| D�� |  ��ʾ��10.00 mL 0.050 mol•L-1��������μ���0.025 mol•L-1�İ�ˮʱ��Һ��pH�仯������ V1��20.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
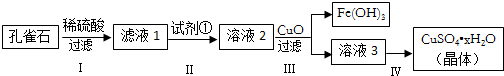
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
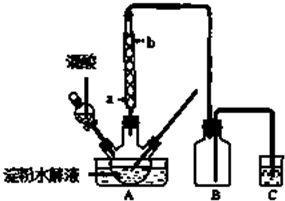
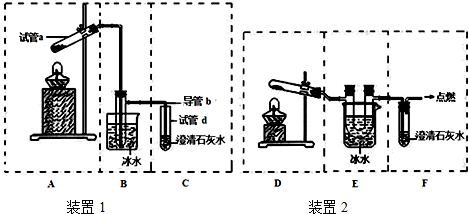
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K2CO3��Һ�У�$\frac{1}{2}$c��K+��=c��CO32-��+c��HCO3-��+c��H2CO3�� | |
| B�� | ijŨ�ȵ�NaAc��Һ��pH=8�������Һ�е�c��Na+��-c��Ac-��=9.9��10-7mol/L | |
| C�� | ���ʵ���Ũ����ȵĢ�NH4Cl���ڣ�NH4��2SO4������Һ��c��NH4+����С˳��Ϊ���٣��� | |
| D�� | 10mLpH=12���ռ���Һ�м���pH=2����HA�����ԣ���������Һ�����V��10mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | CuCl2 | B�� | SO3 | C�� | FeCl3 | D�� | NO2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com