
科目:高中化学 来源: 题型:选择题
| A. | 质量数相同,互为同位素 | |
| B. | 质子数相同,互为同位素 | |
| C. | 中子数相同,属同一种元素的不同核素 | |
| D. | 核外电子数相同,中子数不同,不能互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “三聚氰胺”奶粉事件是化学问题,不是商家的道德问题 | |
| B. | 爆炸一定是化学变化 | |
| C. | 某国产化妆品的生产不使用任何化学原理和方法 | |
| D. | 我们学习化学学科,应该做到:准确理解、辩证看待以及正面传播它 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
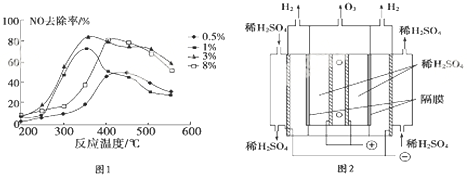
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
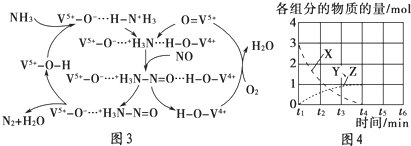
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{576v}$mol/L | B. | $\frac{125a}{36v}$mol/L | C. | $\frac{250a}{36v}$mol/L | D. | $\frac{250a}{48v}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
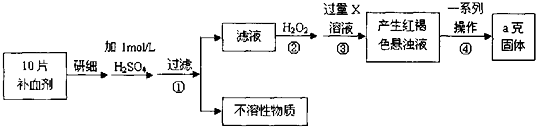
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
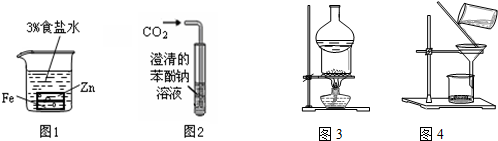
| A. | 图1中正极反应是Zn-2e-=Zn2+ | |
| B. | 图2可用于比较碳酸、苯酚酸性的强弱 | |
| C. | 图3可用于I2与NH4Cl混合物的分离 | |
| D. | 图4用于去除Fe(OH)3胶体中含有的可溶性物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com