
 .
.分析 (1)氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目;
(2)根据反应中Mn元素的化合价降低、Cl元素的化合价升高来分析氧化剂、还原剂;根据反应及Cl原子守恒来分析计算;
(3)反应中HCl化合价升高,表现还原性,生成氯化锰表现酸性;
(4)因为MnO4-具有强氧化性,会与Cl-发生氧化还原反应生成有毒的Cl2.
解答 解:(1)根据反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中元素化合价的变化,可得该反应电子转移的方向和数目如下所示: ,
,
故答案为: ;
;
(2)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7降低为+2,KMnO4为氧化剂;由方程式可知,2molKMnO4反应时有16molHCl反应,其中10molHCl被氧化,则当有1mol氧化剂参加反应时,被氧化的还原剂的物质的量是5mol,产生氯气为2.5mol,即在标准状况下的体积为56L;
故答案为:KMnO4;HCl;5mol;56L;
(3)反应中HCl化合价升高,表现还原性,生成氯化锰表现酸性;
故答案为:AB;
(4)MnO4-具有强氧化性,会与Cl-发生氧化还原反应生成有毒的Cl2,造成空气污染,所以实验室处理含MnO${\;}_{4}^{-}$废液时,要防止与含有Cl-的废液混合;
故答案为:防止与含有Cl-的溶液混合.
点评 本题考查氧化还原反应,明确元素的化合价变化是解答的关键,并注意HCl在反应中的作用及利用原子守恒的方法来解答即可,难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应速率与I•的浓度有关 | B. | M是该反应的催化剂 | ||
| C. | 反应①与②的活化能相等 | D. | v(H2)=v(I2)=v(HI) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;指出分子中化学键是共价键(填‘离子键’或‘共价键’).
;指出分子中化学键是共价键(填‘离子键’或‘共价键’).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).
某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
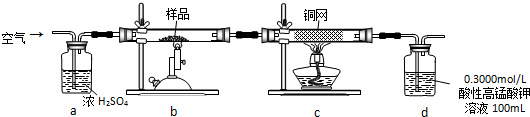
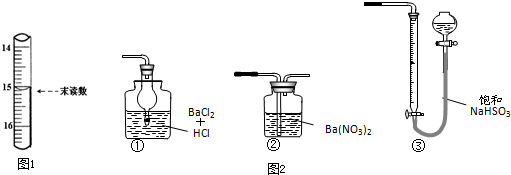
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
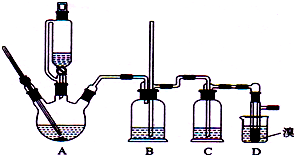 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com