
已知下列热化学方程式:
Zn(s)+O2(g)═ZnO(s)△H=﹣Q1 kJ/mol
Hg(l)+O2(g)═HgO(s)△H=﹣Q2kJ/mol
Zn(s)+HgO(s)═Hg(l)+ZnO(s)△H=﹣Q3kJ/mol
Q3值为()
A. Q2﹣Q1 B. Q1+Q2 C. Q1﹣Q2 D. ﹣Q1﹣Q2
考点: 用盖斯定律进行有关反应热的计算.
分析: 已知热化学方程式:①Zn(s)+O2(g)═ZnO(s)△H=﹣Q1 kJ/mol、②Hg(l)+O2(g)═HgO(s)△H=﹣Q2kJ/mol,根据盖斯定律①﹣②得:Zn(s)+HgO(s)═ZnO(s)+Hg(1),据此计算出Q3.
解答: 解:由①Zn(s)+O2(g)═ZnO(s)△H=﹣Q1 kJ/mol,
②Hg(l)+O2(g)═HgO(s)△H=﹣Q2kJ/mol,
则根据盖斯定律可知,①﹣②得Zn(s)+HgO(s)═ZnO(s)+Hg(1),
所以△H=﹣Q3=﹣Q1﹣(﹣Q2)=Q2﹣Q1,即:Q3=Q1﹣Q2,
故选C.
点评: 本题考查学生利用盖斯定律计算反应热,题目难度不大,关键在于构造反应过程,注意掌握盖斯定律的概念及应用方法,试题培养了学生灵活应用基础知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
海水是巨大的资源宝库.如图1是从海水中提取食盐和溴的主要流程.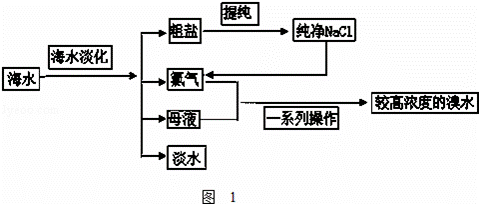
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.如图2是粗盐提纯的操作流程.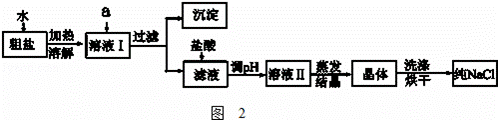
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液.
①除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、 、
②如何证明操作①中NaOH溶液已经过量?
③蒸发过程所用的主要仪器有:铁架台、酒精灯、 ;
某同学欲四氯化碳萃取较高浓度的溴水中的溴,经振荡并在铁架台上静置分层后,
①分离出四氯化碳层的操作: .②分离碘的四氯化碳溶液的操作方法是:
(3)工业上将较高浓度的溴水经进一步处理得到工业溴.某研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为 59℃,微溶于水,有毒性和强腐蚀性.水的沸点为100℃.他们参观生产过程后,设计了如图3装置简图: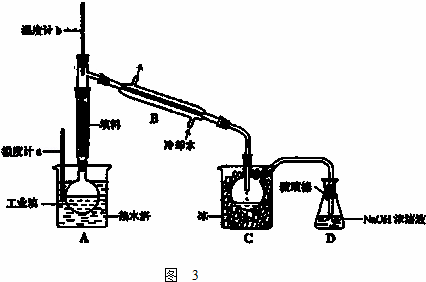
①图中仪器B的名称: .
②用热水浴加热的优点是: .
③实验装置气密性良好,要达到提纯溴的目的,收集溴时温度计应控制的温度为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
|
| A. | 0.012kg 12C含有的12C是NA个 |
|
| B. | NA个水分子的质量是18g/mol |
|
| C. | 1mol O2中含有的氧气分子数为NA个 |
|
| D. | 含有NA个氧原子的H2SO4的物质的量是0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为 ,物质的量之比为 ,原子总数之比为 ,密度之比为 .
(2)在标准状况下,4g H2、11.2L O2、1mol H2O中,所含分子数最多的是 ,含原子数最多的是 ,体积最小的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=﹣lgc(M),p(CO32﹣)=﹣lgc(CO32﹣).下列说法正确的是()
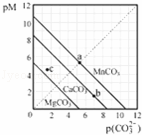
A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a点可表示MnCO3的饱和溶液,且c(Mn2+)<c(CO32﹣)
C. b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32﹣)
D. c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是()
A. 电解硫酸时,阴极产生1molH2时,阳极一定产生0.5molO2
B. 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
C. 电解1mol熔融的Al2O3,能产生33.6L氧气、54.0g金属铝
D. 工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上就溶解0.5NA个铜原子
查看答案和解析>>
科目:高中化学 来源: 题型:
关于化学键的下列叙述中,正确的是( )
|
| A. | 离子化合物一定含共价键 |
|
| B. | 共价化合物可能含离子键 |
|
| C. | 离子化合物中只含离子键 |
|
| D. | 共价化合物中肯定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
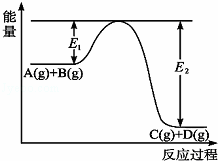
反应A(g)+B(g)⇌C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
(1)该反应是 (填“吸热”或“放热”)反应.
(2)当反应达到平衡时,升高温度,A的转化率减小(填“增大”“减小”或“不变”),原因是 .
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”“减小”或“不变”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com