
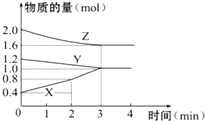
 某温度时,在容积为3L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在容积为3L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:分析 (1)根据图知,随着反应进行,X的物质的量增大、Y和Z的物质的量减少,则X是生成物、Y和Z是反应物,达到平衡状态时,△n(X)=(1.0-0.4)mol=0.6mol、△n(Y)=(1.2-1.0)mol=0.2mol、△n(Z)=(2.0-1.6)mol=0.4mol,同一反应中同一时间段内各物质的计量数之比等于物质的量变化量之比,据此书写方程式;
(2)反应开始至2min末,X的反应速率=$\frac{\frac{△n}{V}}{△t}$;
(3)根据图知,反应开始时反应物和生成物都有,所以开始时正逆反应同时进行;
(4)若增加Y的用量,化学反应速率不变化,说明Y不存在浓度而言.
解答 解:(1)根据图知,随着反应进行,X的物质的量增大、Y和Z的物质的量减少,则X是生成物、Y和Z是反应物,达到平衡状态时,△n(X)=(1.0-0.4)mol=0.6mol、△n(Y)=(1.2-1.0)mol=0.2mol、△n(Z)=(2.0-1.6)mol=0.4mol,同一反应中同一时间段内各物质的计量数之比等于物质的量变化量之比,所以Y、Z、X的计量数之比=0.2mol:0.4mol:0.6mol=1:2:3,反应方程式为Y+2Z?3X,
故答案为:Y+2Z?3X;
(2)反应开始至2min末,X的反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(0.8-0.4)mol}{3L}}{2min}$=0.067mol/(L.min),故答案为:0.067mol/(L.min);
(3)根据图知,反应开始时反应物和生成物都有,所以开始时正逆反应同时进行,故选③;
(4)若增加Y的用量,化学反应速率不变化,说明Y不存在浓度而言,所以Y为固态或纯液态,
故答案为:固或纯液.
点评 本题考查物质的量随时间变化曲线,侧重考查学生分析计算能力,明确各物质计量数与物质的量变化量关系是解本题关键,易错题是(3)题,知道反应方向判断.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能使溴的四氯化碳溶液褪色 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 硬脂酸甘油脂的相对分子质量为890,故其属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾加入水中主要目的是悬浮杂质沉降 | |
| B. | 塑料、光导纤维、合成橡胶都属于有机高分子化合物 | |
| C. | 向含硫高的煤中加入石灰,可减少燃煤对大气的污染 | |
| D. | 利用二氧化碳等原料合成的聚二氧化碳可降解塑料有利于减少白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x:m:n=1:2:1 | B. | m:n=2:1 | C. | m>2x+2 | D. | m=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的盐酸溶液和pH=11的氨水等体积混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 0.1 mol•L-1 NaHS溶液中:c(H+)+c(H2S)=c(S2-)+c(OH-) | |
| D. | 物质的量浓度相等的HF和NaF溶液等体积混合后:c(Na+)=c(HF)+c(F-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com